Glutamat-Ammonium-Ligase
| Glutamat-Ammonium-Ligase | ||
|---|---|---|

| ||
| Auf- und Seitenansicht der Glutamat-Ammonium-Ligase | ||
|
Vorhandene Strukturdaten: 1f1h, 1f52, 1fpy, 1hto, 1lgr, 2bvc, 2gls, 2qc8, 2ojw | ||
| Eigenschaften des menschlichen Proteins | ||
| Sekundär- bis Quartärstruktur | Homotetramer, Homooktamer | |
| Bezeichner | ||
| Gen-Name | GLUL | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 6.3.1.2, Ligase | |
| Substrat | Glutamat + ATP + NH4+ | |
| Produkte | ADP, Phosphat, L-Glutamin | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2752 | 14645 |
| Ensembl | ENSG00000135821 | ENSMUSG00000026473 |
| UniProt | P15104 | P15105 |
| Refseq (mRNA) | NM_001033044 | NM_008131 |
| Refseq (Protein) | NP_001028216 | NP_032157 |
| Genlocus | Chr 1: 182.38 – 182.39 Mb | Chr 1: 153.9 – 153.91 Mb |
| PubMed-Suche | 2752 | 14645
|
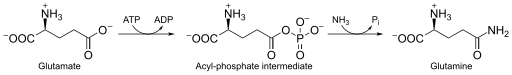
Glutamat-Ammonium-Ligase (kurz GS von veraltet Glutamin-Synthetase) heißen Enzyme, welche unter ATP-Verbrauch Ammonium auf die Aminosäure Glutamat übertragen. Hierbei entsteht die Aminosäure Glutamin. Damit spielen sie eine wichtige Rolle im Stickstoff-Stoffwechsel aller Lebewesen, beispielsweise bei der Biosynthese des Glutamins, welches wiederum als Ausgangspunkt bei der Synthese weiterer Verbindungen dient. Im Menschen dient die GS der Assimilation von toxischem Ammonium und kommt vor allem im Gehirn, der Niere und der Leber vor. Das auf diese Weise auf Glutamat übertragene Ammonium kann in der Leber über den Harnstoffzyklus auf Harnstoff übertragen und somit über die Niere ausgeschieden werden. Die menschliche GS wird außerdem während der frühen Fetalphase exprimiert, eine Stickstoffassimilation wie in Bakterien findet aber nicht statt, da hierzu die dafür essentielle Glutamat Synthase im Menschen nicht vorhanden ist, der Mensch ist daher auf Aminosäurezufuhr angewiesen. Mutationen im GLUL-Gen können zum sehr seltenen fetalen systemischen Glutamin-Mangel führen, der zu schweren Schäden und zum Tod des Neugeborenen führt.[1]
Die GS ist Teil des sogenannten GS/GOGAT-Weges (Glutamin-Synthetase/Glutamin-Oxoglutarat-Aminotransferase), ein alternativer Weg der Assimilation von Ammoniak neben der Reaktion durch die Glutamatdehydrogenase.
Klassen
Die GS ist ein weitverbreitetes Enzym, die verschiedenen Formen lassen sich in drei Klassen einteilen:
- Klasse 1: Dieser Typ findet sich ausschließlich in Prokaryoten und besteht aus zwölf identischen Untereinheiten von jeweils 50 kDa. Das Enzym unterliegt der Kontrolle durch kumulative negative Rückkopplung, die durch eine Vielzahl von Endprodukten des Glutaminmetabolismus vermittelt wird. Ferner wird die Aktivität des Enzyms durch reversible kovalente Modifikation gesteuert. Dabei wird ein bestimmter Tyrosinrest jeder Untereinheit des Enzyms adenyliert, wodurch die Hemmung durch die negative Rückkopplung noch verstärkt wird.
- Klasse 2: In Eukaryoten und bestimmten Bakterien lässt sich dieser Typ finden, der aus zehn identischen Untereinheiten besteht. In Pflanzen finden sich mehrere Isoformen der Glutamin-Synthetase der Klasse 2.
- Klasse 3: GSIII wurde bislang nur in den Bakterien Bacteroides fragilis und Butyrivibrio fibrisolvens gefunden.
Katalysierte Reaktion
Glutamat + ATP + NH3 → Glutamin + ADP + Phosphat