Samarium(II)-bromid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Sm2+ _ Br− | ||||||||||
| Allgemeines | ||||||||||
| Name | Samarium(II)-bromid | |||||||||
| Andere Namen |
Samariumdibromid | |||||||||
| Verhältnisformel | SmBr2 | |||||||||
| Kurzbeschreibung |
rotbrauner Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 310,17 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1250 °C[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Samarium(II)-bromid ist eine anorganische chemische Verbindung des Samariums aus der Gruppe der Bromide.
Gewinnung und Darstellung
Samarium(II)-bromid kann durch Reduktion von Samarium(III)-bromid mit Samarium im Vakuum bei 800 bis 900 °C gewonnen werden.[1]
Auch die Darstellung durch thermische Zersetzung von Samarium(III)-bromid bei 200 °C unter relativ großer Verlusten durch Disproportionierung ist möglich.[1]
Die Verbindung wurde erstmals 1934 durch Selwood durch Reduktion von Samarium(III)-bromid mit Wasserstoff bei 740 °C synthetisiert.[3]
Später wurde Syntheseverfahren aus Samarium(III)-oxid oder aus Lithiumbromid und Samarium(II)-iodid in Tetrahydrofuran oder durch Reaktion von Samarium mit 1,1,2,2-Tetrabromethan entwickelt.[3]
Eigenschaften
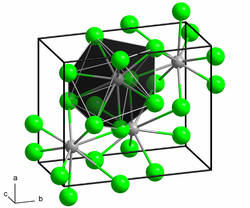
Samarium(II)-bromid ist ein rotbrauner Feststoff. Die Verbindung ist äußerst hygroskopisch und kann nur unter sorgfältig getrocknetem Schutzgas oder im Hochvakuum aufbewahrt und gehandhabt werden. An Luft oder bei Kontakt mit Wasser geht er unter Feuchtigkeitsaufnahme in Hydrate über, die aber instabil sind und sich mehr oder weniger rasch unter Wasserstoff-Entwicklung in Oxidbromide verwandeln. Die Verbindung besitzt eine Kristallstruktur vom Strontiumbromid-Typ bzw. Blei(II)-chlorid-Typ.[1]
Verwendung
Samarium(II)-bromid wird in der organischen Chemie zum Beispiel zur Pinakol-Homokupplung von Aldehyden und Ketonen und Kreuzkupplung von Carbonylverbindungen verwendet, wobei es bei diesen Reaktionen bessere Eigenschaften als das häufig verwendete Samarium(II)-iodid besitzt.[3] Es wird als Reduktionsmittel eingesetzt.[4]
Einzelnachweise
- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1081.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c
- ↑


