Aluminiumbromid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
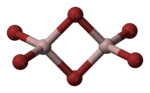
| ||||||||||||||||
| Dimer des Aluminiumbromids: _ Al3+ _ Br− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Aluminiumbromid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | AlBr3 | |||||||||||||||
| Kurzbeschreibung |
glänzende, farblose Blättchen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 266,69 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,2 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−516 kJ·mol−1[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Aluminiumbromid ist eine anorganische chemische Verbindung aus Brom und Aluminium mit der Summenformel AlBr3.
Gewinnung und Darstellung
Aluminiumbromid kann durch Überleiten von Bromdampf über ein glühendes Gemisch aus Kohlenstoff und Aluminiumoxid oder durch die direkte Einwirkung von Brom auf Aluminium synthetisiert werden[6].
Eigenschaften
Die molare Masse beträgt 266,69 g/mol, seine Dichte 3,2 g/cm³. Es hat einen Schmelzpunkt von 97,5 °C und einen Siedepunkt von 263 °C.
Im festen Zustand bildet Aluminiumbromid Al2Br6-Moleküle[1], in denen zwei Bromidionen als Brückenliganden auftreten, was dazu führt, dass das Aluminiumatom ein Elektronenoktett erreicht.
Aluminiumbromid ist in Benzol, Toluol, Schwefelkohlenstoff und vielen weiteren organischen Lösungsmitteln löslich[6]. Es bildet farblose rhombische und an feuchter Luft rauchende Kristalle. Es besitzt eine monokline Kristallstruktur, Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3), a = 1030,82 pm, b = 710,12 pm, c = 753,64 pm, β = 96,418°.[7]
Aluminiumbromid reagiert unter Bildung einer stark sauren Lösung unter heftiger Reaktion mit Wasser.[1] Hierbei werden die Al-Br-Bindungen weitgehend hydrolysiert. Aus der Lösung kristallisiert Aluminiumbromid als Hexahydrat AlBr3 · 6 H2O.
Verwendung
Die Hauptverwendung von Aluminiumbromid ist als Katalysator bei organischen Synthesen, wie beispielsweise der Polymerisation, den Friedel-Crafts-Reaktionen oder der Bromierung.[1]
Einzelnachweise
- ↑ a b c d e f Eintrag zu Aluminiumbromid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ a b c Datenblatt Aluminiumbromid bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c d Eintrag zu Aluminiumbromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b Yoffe, D.; Frim, R.; Ukeles, S.D.; Dagani, M.J.; Barda, H.J.; Benya, T.J.; Sanders, D.C.: Bromine Compounds, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a04_405.pub2.
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116.
- ↑ a b Douglas G. Nicholson et al.: Aluminium bromide. In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 30–36 (englisch).
- ↑ R.W. Berg, F.W. Poulsen, K. Nielsen: Redetermination of the crystal structure of Al2Br6. A comparison of three methods. In: Acta Chemica Scandinavica. 1997, 51, S. 442–448. doi:10.3891/acta.chem.scand.51-0442.


