Alanin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
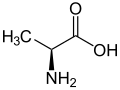
| |||||||||||||||||||
| Strukturformel von L-Alanin, dem natürlich vorkommenden Enantiomer | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Alanin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H7NO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 89,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,40 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Alanin, abgekürzt Ala oder A, ist eine nicht-essentielle α-Aminosäure.
Enantiomere
Alanin ist chiral, tritt also in zwei spiegelbildlichen Formen auf, wobei das L-Alanin eine proteinogene Aminosäure ist, die nach IUPAC auch als (S)-2-Aminopropansäure oder als (S)-Alanin bezeichnet wird. D-Alanin [Synonym: (R)-Alanin] findet man als Baustein des Mureins, der Grundsubstanz von Bakterienzellwänden. Daneben gibt es noch das nichtproteinogene β-Alanin.
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Alanin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Alanin gemeint.
| Enantiomere von Alanin | ||
| Name | L-Alanin | D-Alanin |
| Andere Namen | (S)-Alanin | (R)-Alanin |
| Strukturformel |  |
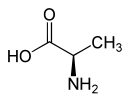
|
| CAS-Nummer | 56-41-7 | 338-69-2 |
| 302-72-7 (Racemat) | ||
| EG-Nummer | 200-273-8 | 206-418-1 |
| 206-126-4 (Racemat) | ||
| ECHA-Infocard | 100.000.249 | 100.005.835 |
| 100.005.571 (Racemat) | ||
| PubChem | 5950 | 71080 |
| 602 (Racemat) | ||
| DrugBank | DB00160 | DB01786 |
| − (Racemat) | ||
| FL-Nummer | 17.002 | - |
| 17.024 (Racemat) | ||
| Wikidata | Q218642 | Q27076975 |
| Q27101911 (Racemat) | ||
Geschichte

Neben Prolin gehört Alanin zu den beiden Aminosäuren, die erstmals durch Synthese dargestellt und nicht zuvor aus pflanzlichem oder tierischem Material isoliert worden sind. Alanin wurde 1850 von Adolph Strecker gefunden, als er eigentlich Milchsäure durch die Umsetzung von Acetaldehyd mit Ammoniak und Blausäure in Gegenwart von Salzsäure synthetisieren wollte, über die nach ihm benannte Strecker-Synthese. Strecker wählte dabei den Namen als Ableitung des Begriffs Aldehyd, da er die Aminosäure aus genanntem Acetaldehyd erhielt.[7][8] Aus organischem Material wurde Alanin erstmals 1875 durch Paul Schützenberger erhalten, als dieser in einem Autoklaven mittels Baryt Seide aufspaltete und eine Mischung aus Glycin und Alanin identifizieren konnte.[6][9] Von den am Aufbau der Proteinkette beteiligten Aminosäuren stellt L-Alanin 29,7 %.[10]
Synthese
Die industrielle Herstellung[11] von L-Alanin erfolgt ausgehend von der L-Asparaginsäure durch Abspaltung der β-Carboxygruppe in einem biotechnologischen Verfahren. Durch Strecker-Synthese gewonnenes racemisches Alanin kann an der Aminogruppe acetyliert werden und wird dann einer Racematspaltung[12] unterworfen. Dabei wird unter Verwendung von L-Aminoacylase[13] enantioselektiv die Acetylgruppe von L-N-Acetylalanin abgespalten und es entsteht L-Alanin, während D-N-Acetylalanin nicht hydrolysiert wird. Die Trennung von L-Alanin und D-N-Acetylalanin ist einfach. Benötigt man D-Alanin, so wird D-N-Acetylalanin unter sauren Bedingungen hydrolysiert, d. h., die Acetylgruppe wird abgespalten. Wenn kein Bedarf für D-Alanin besteht, wird das bei der kinetischen Racematspaltung anfallende D-N-Acetylalanin durch Einwirkung von Essigsäureanhydrid racemisiert und recycliert.
DL-Alanin kann auch aus 2-Brompropansäure synthetisiert werden, dieses Verfahren besitzt jedoch keine industrielle Bedeutung.
Im Stoffwechsel wird L-Alanin durch Transaminierung aus dem Endprodukt der Glykolyse, dem Pyruvat, synthetisiert. Bakterien erhalten benötigtes D-Alanin aus L-Alanin mittels des Enzyms Alaninracemase (EC 5.1.1.1).[14]
Eigenschaften
Alanin liegt meist als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
Beim physiologischen pH-Wert von 7,4 liegt ein großer Teil der Alanin-Moleküle als Zwitterion vor. Der isoelektrische Punkt von Alanin liegt bei pH 6,1 und Alanin erreicht seine geringste Löslichkeit in Wasser, da fast alle Alanin-Moleküle als Zwitterionen vorliegen. Die Lösung hat an diesem Punkt die geringste elektrische Leitfähigkeit, da Zwitterionen als Ganzes ungeladen sind.
Physiologische Funktionen
In Umkehrung dieser Synthese-Reaktion kann es enzymatisch auch wieder zu Pyruvat abgebaut werden (Transaminierung). So kann das Kohlenstoffgrundgerüst über Pyruvat wieder zum Aufbau von Glucose (Gluconeogenese) verwendet oder über den Zitronensäurezyklus vollständig zur Energiegewinnung abgebaut werden. Die oxidative Desaminierung des L-Alanins zu Pyruvat und Ammoniak, katalysiert durch das Enzym Alanin-Dehydrogenase, stellt eine weitere Abbaumöglichkeit dar; sie macht beispielhaft deutlich, wie ein Teil des Aminosäurestoffwechsels mit dem Kohlenhydratstoffwechsel verknüpft ist.
L-Alanin ist eine für den Menschen nicht-essentielle Aminosäure, kann also biosynthetisch durch den menschlichen Stoffwechsel hergestellt werden.
Alanin tritt – neben anderen Aminosäuren wie z. B. Leucin und Glutaminsäure – in α-Helices von Proteinen bevorzugt auf. Diese Aminosäuren begünstigen die Bildung dieses Sekundärstrukturelements und werden deshalb auch als Helixbildner bezeichnet.[15]
Verwendung
L-Alanin ist Bestandteil von Infusionslösungen zur parenteralen Ernährung und von Diätetika.[16]
Die beiden Enantiomeren des Alanins werden, mit einer Schutzgruppe versehen, häufig für die Synthese von Peptiden und Proteinen eingesetzt.[17][18] Weiterhin werden L- oder D-Alanin auch in der stereoselektiven Synthese als Edukt eingesetzt.[19][20][21]
Verwandte Verbindungen
Siehe auch
Weblinks
Einzelnachweise
- ↑ Eintrag zu ALANINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d Eintrag zu Alanin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Alanin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Mai 2014.
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart 1991, ISBN 3-7776-0485-2, S. 822.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. 1. Student Edition. CRC Press, Boca Raton, Florida 1988, ISBN 0-8493-0740-6, S. C-706.
- ↑ a b P. Schützenberger, Untersuchungen über die Eiweisskörper, Chem Centralblatt, Band 285–286 (1876).
- ↑ Biografie von Adolph Strecker (Memento vom 21. Januar 2012 im Internet Archive)
- ↑ Adolph Strecker: Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper. In: Annalen der Chemie und Pharmacie. 75, 1850, S. 27–45, doi:10.1002/jlac.18500750103.
- ↑ S. Hansen: Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois. (Memento vom 15. Juni 2016 im Internet Archive) Berlin 2015.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2, S. 19.
- ↑ Yoshiharu Izumi, Ichiro Chibata, Tamio Itoh: Herstellung und Verwendung von Aminosäuren. In: Angewandte Chemie. 90 (1987) S. 187–194; auch In: Angewandte Chemie International Edition. in Englisch, 17 (1978), S. 176–183, doi:10.1002/anie.197801761.
- ↑ Hans-Ulrich Blaser, Elke Schmidt: Asymmetric Catalysis on Industrial Scale. 1. Auflage. 2003, ISBN 3-527-30631-5, dort Aufsatz von Harald Gröger und Karlheinz Drauz auf S. 131–145.
- ↑ W. Hartmeier: Immobilisierte Biokatalysatoren — auf dem Weg zur zweiten Generation. In: Naturwissenschaften. 72, (1985) S. 310–314 und dort zitierte Literatur.
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 20. Auflage. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2.
- ↑ Berg, Tymozcko, Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg/ Berlin 2003, ISBN 3-8274-1303-6.
- ↑ S. Ebel, H. J. Roth (Hrsg.): Lexikon der Pharmazie. Georg Thieme Verlag, 1987, ISBN 3-13-672201-9, S. 17.
- ↑ Jesse Philip Greenstein, Milton Winitz: Chemistry of Amino Acids. Band 1–3, John Wiley & Sons, 1961, ISBN 0-471-32637-2.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2.
- ↑ Karlheinz Drauz, Axel Kleemann, Jürgen Martens: Induktion von Asymmetrie durch Aminosäuren. In: Angewandte Chemie. Band 94, Nr. 8, 1982, S. 590–613, doi:10.1002/ange.19820940804.
- ↑ Jürgen Martens: Asymmetric syntheses with amino acids. In: Topics in current chemistry. Band 125. Springer, Berlin 1984, ISBN 978-3-540-13569-2, S. 165–246, doi:10.1007/3-540-13569-3_5.
- ↑ Gary M. Coppola, Garry M. Coppola: Asymmetric Synthesis: Construction of Chiral Molecules Using Amino Acids. 2. Auflage. John Wiley & Sons, 1987, ISBN 0-471-82874-2.
