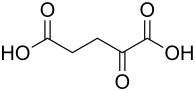
α-Ketoglutarsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | α-Ketoglutarsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C5H6O5 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, fast geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 146,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung ab 160 °C[2] | ||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (100 g·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
α-Ketoglutarsäure (2-Oxoglutarsäure, 2-Oxopentandisäure) ist eine sich vom n-Pentan ableitende Dicarbonsäure, die eine zusätzliche Carbonylgruppe am α-C-Atom trägt. Sie bildet farblose, fast geruchlose Kristalle. Ihre Salze heißen α-Ketoglutarate. Sie treten als Zwischenprodukte des Stoffwechsels, z. B. im Citratzyklus oder in wichtigen Schritten des Stickstoffmetabolismus, in Erscheinung. α-Ketoglutarsäure (AKG) ist ein natürlich vorkommender, stickstofffreier Anteil der Aminosäuren Glutamin und Glutaminsäure. α-Ketoglutarsäure (AKG), in der wässrigen Umgebung innerhalb einer Zelle genauer ihr Anion α-Ketoglutarat, ist ein Zwischenprodukt im Energiestoffwechsel bei der ATP-Produktion in den Zellen über den Citratzyklus. Es ist ein stärkerer Radikalfänger (RONS) als Vitamin C in der äquivalenten Dosis und wirkt als Stickstoffregulator im Stoffwechsel. Der pathologische Stoffwechsel von Krebszellen ist auch durch eine erhöhte Bildung von Stickstoffbasen gekennzeichnet. Die von den Krebszellen freigesetzten Stickstoffverbindungen werden mit α-Ketoglutarsäure (AKG) entfernt, somit gleicht sie die Stickstoffbelastung des Körpers aus und verhindert eine Stickstoffüberlastung von Körpergewebe und -flüssigkeiten.
Biosynthese von α-Ketoglutarsäure
Das Enzym Glutamatdehydrogenase (GDH, auch GLD) katalysiert die Reaktion von L-Glutamat, Wasser und NAD(P)+ zu Ammonium, α-Ketoglutarat und NAD(P)H. Die Rückreaktion zu L-Glutamat wird ebenfalls von diesem Enzym katalysiert. Damit ist α-Ketoglutarat ein Teil des Stickstoffmetabolismus und für die Fixierung (Assimilation) bzw. Freisetzung (Dissimilation) von Ammonium von zentraler Bedeutung. Beim Menschen existieren zwei Gene (GLUD1 und GLUD2), die für zwei Isoformen der GDH codieren, wobei GLUD2 besonders in der Netzhaut, den Hoden und im Gehirn exprimiert wird. Mutationen an GLUD1 können zum Hyperinsulinismus-Hyperammonämie-Syndrom führen. Während die GDHs höherer Eukaryoten beide Cofaktoren (NADH und NADPH) nutzen können, sind die GDHs von Prokaryoten und niederer Eukaryoten von einem bestimmten Coenzym abhängig. Hierbei sind NADPH-abhängigen GDHs üblicherweise anabole Enzyme und katalysieren die Assimilation von Ammonium, während NADH-abhängig GDHs zum Katabolismus beitragen und Ammonium meist dissimilieren.
Eigenschaften und Verwendung
α-Ketoglutarsäure in der Chirurgie
α-Ketoglutarsäure führt zu schnelleren Optimierung von Operationen durch Erhöhung der ATP-Synthese[4][5] und metabolische Unterstützung der Sauerstoffversorgung in der Herz-[6] bzw. Skelettmuskulatur (Proteinsynthese)[7] und andere damit verbundene Verbesserungen der Körperleistung. Die Supplementation mit α-Ketoglutarsäure optimiert den Verlauf der Operation[8] durch die präventive Reduzierung von oxidativem Stress und die Begrenzung eines oxidativen Anstiegs während der Operation,[9] sowie den Rückgang der Bildung von im Überschuss vorhandenen aus freien Radikalen gebildeten reaktiven Spezies (RONS). Des Weiteren ist α-Ketoglutarsäure in der Lage die Heilungsrate bei vielen Erkrankungen durch die erhöhte ATP-Synthese[4][5] und Aktivität des Mitochondrien-Enzyms (Energieproduktion) zu erhöhen.[6]
Physiologische Bedeutung
α-Ketoglutarsäure im Citratzyklus
Im Citratzyklus werden täglich 1,5 – 2 kg α-Ketoglutarsäure gebildet und sofort weiter zu Succinyl-CoA umgesetzt, die ebenfalls ein Bestandteil des Citratzyklus ist. Der Citratzyklus, der in der mitochondrialen Matrix lokalisiert ist, dient in erster Linie dem oxidativen Abbau von Acetyl-CoA, das beim Abbau von Kohlenhydraten aus Pyruvat, beim Abbau der Fettsäuren durch β-Oxidation und schließlich beim Abbau einiger Aminosäuren entsteht. Acetyl-CoA wird in einem zyklischen Vorgang, dem Citratzyklus, zu CO2 und Reduktionsäquivalenten (NADH, FADH) abgebaut. Die Reoxidation dieser Reduktionsäquivalente in der Atmungskette liefert erhebliche Energiemengen in Form von ATP. Der Citratzyklus steht in engem Zusammenhang mit dem Kohlenhydrat-, Fett- und Aminosäurestoffwechsel und liefert Ausgangsprodukte für die Gluconeogenese, die Fettsäurebiosynthese, die Hämbiosynthese und die Synthese nicht-essentieller Aminosäuren. Die Regulation des Citratzyklus erfolgt über den zellulären Energiebedarf. Ist dieser erhöht, kommt es zur Aktivierung des Enzymkomplexes. In der Bilanz entstehen pro Mol Acetyl-Rest im Citratzyklus 2 Mol CO2, 3 Mol NADH/H+ und 1 Mol reduziertes Ubichinol. Durch oxidative Phosphorylierung gewinnt die Zelle aus diesen reduzierten Co-Enzymen 12 Mol ATP.[10][11][12]
α-Ketoglutarsäure im Sport
α-Ketoglutarsäure spielt besonders im Sport eine wichtige Rolle. „Eine Supplementierung mit α-Ketoglutarsäure ist in der derzeitigen Anwendungsform und körpergewichtsadaptierten Dosierung gesundheitlich sicher“. Diese führt zu einer gesteigerten Belastbarkeit sowie zu einer zusätzlichen Verbesserung der Trainingseffekte unter sportlicher Aktivität. Des Weiteren beschleunigt die Supplementierung mit α-Ketoglutarsäure die Harnstoffsynthese bei körperlichem Training und provoziert im Hinblick eine reduzierte Harnstoffproduktion.[13]
Pharmakokinetik und Metabolismus
Außerhalb des Citratzyklus gibt es drei weitere wichtige Stoffwechselwege, an denen α-Ketoglutarsäure beteiligt ist. α-Ketoglutarsäure kann zur Herstellung von 2,5-Dioxopentanoat als Zwischenprodukt für den Ascorbat- und Aldaratstoffwechsel verwendet werden. Sie kann reversibel zu L-Glutamat und weiter zu Glutamin metabolisiert werden.
Der α-Ketoglutarat-Malat-Carrier (OGC) (auch mitochondriales 2-Oxoglutarat-Malat-Carrierprotein, Gen: SLC25A11) ist dasjenige Protein, das den Austausch von α-Ketoglutarat und Malat durch die innere Zellmembran von Mitochondrien ermöglicht. Es ist eines von zwei Transportproteinen im Malat-Aspartat-Shuttle und damit unentbehrlich für den Energiestoffwechsel in Eukaryoten.
Der katalysierte Membrantransport ist:
α-Ketoglutarat (außen) + Malat (innen) ⇔ α-Ketoglutarat (innen) + Malat (außen)
Es handelt sich also um einen Antiport. Statt Malat können auch Anionen anderer Dicarbonsäuren und Glutathion transportiert werden.[14]
Es wurde beschrieben, dass das Molekül bei Schweinen schnell eliminiert wurde.[15] α-Ketoglutarsäure wurde enteral über die Portalvene mit einer Halbwertszeit von weniger als 5 Minuten verabreicht. Die Erklärung für eine so kurze Lebensdauer ist mit dem Leberstoffwechsel verbunden. Im Jahr 1979 wurde beobachtet, dass Ratten mit dem Yoshida- und Walker-Karzinom eine Zunahme der täglichen α-Ketoglutarsäure-Ausscheidung im Urin zeigen.[16] Die gleiche Beobachtung wurde auch im Zusammenhang mit einer früheren 4-jährigen Studie unter 200 Patienten gemacht, bei der auch eine erhöhte α-Ketoglutarsäure-Ausscheidung festgestellt wurde.[17] Anschließende Experimente zeigten an Hunden, die sich im katabolen Zustand befanden, ähnliche Ergebnisse, nachdem eine Infusionslösung mit einer maximalen Konzentration von 20 μmol/kg/min verabreicht wurde. Sie fanden heraus, dass die Konzentration von α-Ketoglutarsäure die höchste in den Skelettmuskeln war, gefolgt von Niere, Leber und Darm.[18]
Funktion
Mechanismus
α-Ketoglutarsäure spielt eine wichtige Rolle in menschlichen Zellen. Es kann sich mit Ammoniak zu Glutamat und dann zu Glutamin verbinden. Durch Transaminase und Glutamatdehydrogenase kann sie den Überschuss an stickstoffproduzierendem Harnstoff modulieren und ist auch als Co-Substrat an wichtigen oxidativen Reaktionen beteiligt. Auf diesen Weg kann α-Ketoglutarsäure in Kombination mit Ornithin als antikatabole Ergänzung für Patienten eingesetzt werden, die sich einer chirurgischen Operation oder schweren Verbrennungen oder anderen Verletzungen unterziehen,[19] insbesondere durch eine "schonende Wirkung" auf das Glutaminbecken.[5][7] Velvizhi fand heraus, dass α-Ketoglutarsäure eine chemopräventive Wirkung während der Hepatokarzinogenese durch eine positive Modulation der Transaminaseaktivitäten und des oxidativ-antioxidativen Ungleichgewichts ausüben kann.[20] Innerhalb des Citratzyklus sind zwei Enzyme von grundlegender Bedeutung: Succinatdehydrogenase (SDH) und Fumarathydratase (FH). Der Mangel an diesen beiden Enzymen induziert Pseudohypoxie durch Aktivierung des hypoxieinduzierbaren Faktors (HIF durch Stabilisierung des HIF1α Faktors durch Succinat oder Fumarat). HIF1α ist ein Transkriptionsfaktor, der Gene wie die an der Angiogenese und Glykolyse beteiligten hochreguliert. Es spielt auch eine zentrale Rolle bei der Regulierung der zellulären Nutzung von Sauerstoff und ist ein wesentlicher Regulator der Angiogenese bei ischämischen Störungen des soliden Tumors und ischämischen Erkrankungen.[21] MacKenzie zeigte, dass eine erhöhte intrazelluläre Konzentration von α-Ketoglutarsäure diesen Mechanismus kontrastieren kann und deutet auch darauf hin, dass die Verwendung von Esterderivaten zur Verbesserung der Membranpermeabilität führt.[22] Mehr als 90 % des glykolytischen Pyruvats wird zur Laktatbildung umgeleitet. Die meisten der verbleibenden Brenztraubenkohlenstoffe gelangen in einen verkürzten Citratzyklus, aus dem das Citrat vorzugsweise in das Cytosol extrudiert wird, wo es eine bereits deregulierte Sterolsynthese speist. Glutamin ist ein Hauptsubstrat für den tumorösen Citratzyklus: Es wird vorzugsweise durch intra-mitochondriale Glutaminase in Glutamat umgewandelt. Glutamat wird meist zu α-Ketoglutarsäure transaminiert, das in den Citratzyklus eintritt.[23] Das bedeutet, dass die Verabreichung von α-Ketoglutarsäure dazu beitragen kann, den mitochondrialen Stoffwechsel, insbesondere die Citratzykluswege, zu regulieren. α-Ketoglutarsäure ist auch eine wichtige Komponente zur Aktivierung von HIF-1α Prolin-Hydroxylasen (PHD),[21] einem Schlüsselenzym zur Hemmung von HIF1α, das für die Aktivierung von HIF verantwortlich ist. HIF ist der hypoxieinduzierbare Faktor, der im Zustand der Normoxie nicht aktiviert wird. Die Einführung von α-Ketoglutarsäure stellt die normale PHD-Aktivität und das Niveau von HIF1α wieder her und zeigt neue Therapiemöglichkeiten im Zusammenhang mit der TCA-Zyklus-Dysfunktion.[21] Perera zeigte die Wirksamkeit von Alpha-Ketosäuren wie α-Ketoglutarsäure in Bezug auf ihren möglichen Einsatz als Therapeutika im Krankheitsprozess unter oxidativem Stress.[24]
Antioxidative Eigenschaften
In vielen Oxygenasen unterstützt α-Ketoglutarsäure die Reaktion, indem es zusammen mit dem Hauptsubstrat oxidiert wird. Tatsächlich ist eine der alpha-Ketoglutarat-abhängigen Oxygenasen ein O2-Sensor, der den Organismus über den Sauerstoffgehalt in seiner Umgebung informiert. Der Hauptbereich der Produktion von Superoxid, die primäre reaktive Sauerstoffspezies (ROS), gilt als die Atmungskette in den Mitochondrien. Es wurde auch beschrieben, dass das beschädigte Schlüsselenzym des Citratzyklus, z. B. α-Ketoglutarsäure-Dehydrogenase (AKGDH), auch ROS produzieren kann. Die konvertierte AKGD ist ein Schlüsselfaktor, durch den oxidativer Stress induziert und in Nervenendigungen gefördert wird. Es hat wichtige Funktionen bei Oxidationsreaktionen mit molekularem Sauerstoff, z. B. in vielen Oxygenasen (z. B. AKGDH), um deren Schädigung oder Dysfunktion zu verhindern (O2-Sensor). Interessanterweise reagiert α-Ketoglutarsäure mit dem intrazellulären H2O2, das nicht-enzymatisch Succinat bildet, dass selbst ein notwendiges Zwischenprodukt im Citratzyklus ist.
Detoxifikation
α-Ketoglutarsäure entfernt den durch den Abbau von Aminosäuren freigesetzte Stickstoffverbindungen, gleicht so den Stickstoffhaushalt des Körpers aus. Durch übermäßige Proteinaufnahme oder schlechten Aminosäurestoffwechsel kann sich überschüssige Stickstoff und Ammoniak im Zellgewebe ansammeln. α-Ketoglutarsäure ist einer der wichtigsten Stickstofftransporter in Stoffwechselwegen. Die Aminogruppen der Aminosäuren werden durch Transaminierung an sie gebunden und in die Leber transportiert, wo der Harnstoffzyklus stattfindet. α-Ketoglutarsäure wird zusammen mit Glutamin transaminiert, um den erregenden Neurotransmitter Glutamat zu bilden. Dies ist eine enzymatisch gesteuerte Entgiftung von Ammoniak aus dem Gewebe. Das Hauptproduktionsgebiet von Superoxid, die primäre reaktive Sauerstoffspezies (ROS), gilt als die Atmungskette in den Mitochondrien, aber der genaue Mechanismus und die physiologisch relevante ROS-Generation innerhalb der Atmungskette ist noch nicht untersucht. Kürzlich wurde beschrieben, dass ein Schlüsselenzym des Citratzyklus, die α-Ketoglutarsäure-Dehydrogenase (AKGDH), auch nach oxidativer Modifikation (= konvertiertes AKGDH) ROS produzieren kann. Da konvertiertes AKGDH nicht nur ein Generator, sondern auch ein Ziel von ROS ist, wird vorgeschlagen, dass konvertiertes AKGD ein Schlüsselfaktor ist, durch den oxidativer Stress induziert und in Nervenendigungen gefördert wird. α-Ketoglutarsäure wird empfohlen, um eine oxidative Veränderung von AKGDH in der inneren Membran der Mitochondrien zu verhindern, die bei der Erzeugung von Zellenergie durch den chemischen Energietransfer während des Citratzyklus einbezogen werden. Darüber hinaus wurde α-Ketoglutarsäure als das wahrscheinlichste physiologische Anion identifiziert, das an der renalen proximalen Basolateralmembran im Tubulus beim Dicarboxylat/organischer Anionenaustausch beteiligt ist.[25]
Einzelnachweise
- ↑ Eintrag zu KETOGLUTARIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 5. Mai 2020.
- ↑ a b c Datenblatt 2-Oxoglutarsäure bei Merck, abgerufen am 8. Mai 2017.
- ↑ a b c Datenblatt α-Ketoglutaric acid bei Sigma-Aldrich, abgerufen am 8. Mai 2017 (PDF).
- ↑ a b P. Junghans, M. Derno, S. Pierzynowski, U. Hennig, P. Eberhard Rudolph, W. B. Souffrant: Intraduodenal infusion of alpha-ketoglutarate decreases whole body energy expenditure in growing pigs. In: Clinical nutrition. Band 25, Nummer 3, Juni 2006, S. 489–496, doi:10.1016/j.clnu.2005.11.003, PMID 16376464.
- ↑ a b c L. A. Cynober: The use of alpha-ketoglutarate salts in clinical nutrition and metabolic care. In: Current opinion in clinical nutrition and metabolic care. Band 2, Nummer 1, Januar 1999, S. 33–37, PMID 10453328.
- ↑ a b U. Kjellman, K. Björk, R. Ekroth, H. Karlsson, R. Jagenburg, F. Nilsson, G. Svensson, J. Wernerman: Alpha-ketoglutarate for myocardial protection in heart surgery. In: The Lancet. Band 345, Nummer 8949, März 1995, S. 552–553, doi:10.1016/s0140-6736(95)90466-2, PMID 7776775.
- ↑ a b F. Hammarqvist, J. Wernerman, A. von der Decken, E. Vinnars: Alpha-ketoglutarate preserves protein synthesis and free glutamine in skeletal muscle after surgery. In: Surgery. Band 109, Nummer 1, Januar 1991, S. 28–36, PMID 1898624.
- ↑ V. Matzi, J. Lindenmann, A. Muench, J. Greilberger, H. Juan, R. Wintersteiger, A. Maier, F. M. Smolle-Juettner: The impact of preoperative micronutrient supplementation in lung surgery. A prospective randomized trial of oral supplementation of combined alpha-ketoglutaric acid and 5-hydroxymethylfurfural. In: European journal of cardio-thoracic surgery: official journal of the European Association for Cardio-thoracic Surgery. Band 32, Nummer 5, November 2007, S. 776–782, doi:10.1016/j.ejcts.2007.07.016, PMID 17768058.
- ↑ D. E. van Hoorn, R. J. Nijveldt, P. G. Boelens, Z. Hofman, P. A. van Leeuwen, K. van Norren: Effects of preoperative flavonoid supplementation on different organ functions in rats. In: JPEN. Journal of parenteral and enteral nutrition. Band 30, Nummer 4, 2006 Jul-Aug, S. 302–308, doi:10.1177/0148607106030004302, PMID 16804127.
- ↑ Koolman, Rohm et al.: Taschenatlas der Biochemie, 3. Ausgabe, Stuttgart, Thieme, 2002.
- ↑ Buddeke et al.: Grundriss der Biochemie, Walter de Gruyter, Berlin, 1994. 9. Auflage, S. 247–248.
- ↑ Löffler et al.: Basiswissen Biochemie mit Pathobiochemie, Springer–Verlag Berlin, 2000, 4. Auflage. S. 211–225, 277, 278, 570.
- ↑ Gudmund Langanky et al.: Auswirkungen von alpha-Ketoglutarat auf Trainingseffekte, 2011; oparu.uni-ulm.de (PDF; 4,5 MB).
- ↑ Q. Zhong, D. A. Putt, F. Xu, L. H. Lash: Hepatic mitochondrial transport of glutathione: studies in isolated rat liver mitochondria and H4IIE rat hepatoma cells. In: Archives of biochemistry and biophysics. Band 474, Nummer 1, Juni 2008, S. 119–127, doi:10.1016/j.abb.2008.03.008, PMID 18374655, PMC 3840356 (freier Volltext).
- ↑ M. Dabek, D. Kruszewska, R. Filip, A. Hotowy, L. Pierzynowski, A. Wojtasz-Pajak, S. Szymanczyk, J. L. Valverde Piedra, E. Werpachowska, S. G. Pierzynowski: alpha-Ketoglutarate (AKG) absorption from pig intestine and plasma pharmacokinetics. In: Journal of animal physiology and animal nutrition. Band 89, Nummer 11–12, Dezember 2005, S. 419–426, doi:10.1111/j.1439-0396.2005.00566.x, PMID 16401194.
- ↑ R. J. Schaur, W. Schreibmayer, H. J. Semmelrock, H. M. Tillian, E. Schauenstein: Tumor host relations. II. Increase of alpha-ketoglutarate in whole blood and urine and hypoalbuminemia of rats bearing the solid rhabdomyosarcoma BA 1112 and the ascitic or solid forms of Walker-carcinoma 256 and Yoshida-sarcoma. In: Journal of cancer research and clinical oncology. Band 93, Nummer 3, April 1979, S. 293–300, doi:10.1007/bf00964586, PMID 468891.
- ↑ L. Kronberger, H. J. Semmelrock, R. J. Schaur, E. Schauenstein, W. Schreibmayer, E. Fink: Tumor host relations. VI. Is alpha-ketoglutarate a tumor marker? Association with tumor extent in humans–correlation with tumor size in rats. In: Journal of cancer research and clinical oncology. Band 97, Nummer 3, 1980, S. 295–299, doi:10.1007/bf00405781, PMID 7440629.
- ↑ E. Roth, J. Karner, A. Roth-Merten, S. Winkler, L. Valentini, K. Schaupp: Effect of alpha-ketoglutarate infusions on organ balances of glutamine and glutamate in anaesthetized dogs in the catabolic state. In: Clinical science. Band 80, Nummer 6, Juni 1991, S. 625–631, doi:10.1042/cs0800625, PMID 1647927.
- ↑ J. Wernerman, F. Hammarqvist, E. Vinnars: Alpha-ketoglutarate and postoperative muscle catabolism. In: The Lancet. Band 335, Nummer 8691, März 1990, S. 701–703, doi:10.1016/0140-6736(90)90811-i, PMID 1969067.
- ↑ Selvaraj Velvizhi, Kadiyala B Dakshayani, Perumal Subramanian: Effects of α-ketoglutarate on antioxidants and lipid peroxidation products in rats treated with ammonium acetate. In: Nutrition. 18, 2002, S. 747, doi:10.1016/S0899-9007(02)00825-0.
- ↑ a b c A. V. Kozhukhar, I. M. Yasinska, V. V. Sumbayev: Nitric oxide inhibits HIF-1alpha protein accumulation under hypoxic conditions: implication of 2-oxoglutarate and iron. In: Biochimie. Band 88, Nummer 5, Mai 2006, S. 411–418, doi:10.1016/j.biochi.2005.09.007, PMID 16310922.
- ↑ E. D. MacKenzie, M. A. Selak, D. A. Tennant, L. J. Payne, S. Crosby, C. M. Frederiksen, D. G. Watson, E. Gottlieb: Cell-permeating alpha-ketoglutarate derivatives alleviate pseudohypoxia in succinate dehydrogenase-deficient cells. In: Molecular and Cellular Biology. Band 27, Nummer 9, Mai 2007, S. 3282–3289, doi:10.1128/MCB.01927-06, PMID 17325041, PMC 1899954 (freier Volltext).
- ↑ L. G. Baggetto: Deviant energetic metabolism of glycolytic cancer cells. In: Biochimie. Band 74, Nummer 11, November 1992, S. 959–974, doi:10.1016/0300-9084(92)90016-8, PMID 1477140.
- ↑ A. Perera, H. G. Parkes, H. Herz, P. Haycock, D. R. Blake, M. C. Grootveld: High resolution 1H NMR investigations of the reactivities of alpha-keto acid anions with hydrogen peroxide. In: Free radical research. Band 26, Nummer 2, Februar 1997, S. 145–157, doi:10.3109/10715769709097793, PMID 9257126.
- ↑ Edwards et al.: Alpha-ketoglutarate transport in rat renal brushborder and basolateral membrane vesicles. In: JPET, 1997, 281, S. 1059–1064. (Abstract).