Bariumformiat
aus Wikipedia, der freien Enzyklopädie
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumformiat | |||||||||||||||
| Andere Namen |
Bariummethanoat | |||||||||||||||
| Summenformel | C2H2BaO4 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 227,36 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,212 g·cm−3 (Dihydrat)[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bariumformiat ist das Bariumsalz der Ameisensäure mit der Konstitutionsformel Ba(HCOO)2.
Herstellung
Bariumformiat kann durch Reaktion von Bariumhydroxid mit Ameisensäure dargestellt werden.[2]
Eigenschaften
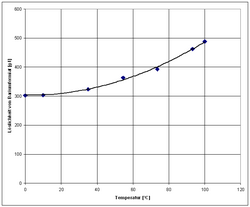
Temperaturabhängigkeit der Löslichkeit von wasserfreiem Bariumformiat in Wasser[3]
Bariumformiat kristallisiert als Dihydrat im orthorhombischen Kristallsystem.[5] Die Kristalle sind isomorph zu Calciumformiat und Strontiumformiat.[2] Das Anhydrat kristallisiert im monoklinen Kristallsystem.[3]
Einzelnachweise
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics, 85th Edition. CRC Press, 2004, ISBN 978-0-8493-0485-9 (books.google.com).
- ↑ a b c d e Richard Abegg, Friedrich Auerbach: Handbuch der anorganischen Chemie, Bd. 2. Verlag S. Hirzel, Leipzig 1908. S. 286; Volltext
- ↑ a b c H. Stanley: "The Solubility of Some Salts of the Lower Fatty Acids" in The Chemical News 1904, 89, S. 193. Volltext
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Barium diformate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Dezember 2019.
- ↑ Paul S. Bechthold und Siegfried Haussühl: Nonlinear optical properties of orthorhombic barium formate and magnesium barium fluoride. In: Applied Physics/A. Materials Science & Processing, Bd. 14 (1977), Heft 4, S. 403–410, doi:10.1007/BF00883447

