Pteridin
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Allgemeines | |||||||
| Name | Pteridin | ||||||
| Andere Namen |
| ||||||
| Summenformel | C6H4N4 | ||||||
| Kurzbeschreibung | |||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 132,12 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt | |||||||
| Löslichkeit |
| ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Pteridin ist ein zweikerniger, aromatischer Heterocyclus, der die Strukturelemente eines Pyrazin- und eines Pyrimidinringes enthält. Die Substanz hat keine große Bedeutung in der Chemie, aber die Konstitutionsformel ist die Stammstruktur der Pterine, worunter Pigmente in den Flügeln einiger Schmetterlinge (Pieridae) fallen, u. a. der Weißlinge Großer Kohlweißling (Pieris brassicae), Rapsweißling (Pieris napi) und Zitronenfalter (Gonepteryx rhamni).[5][6] Die Namen Pterin und Pteridin leiten sich auf Vorschlag von Heinrich Otto Wieland vom griechischen pteron, ‚Flügel‘ ab.[7] Auch die Folsäure enthält den Pteridin- bzw. Pterin-Heterocyclus.
Herstellung
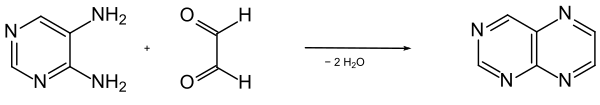
Ein einfacher synthetischer Zugang zu Pteridin besteht in der Kondensation von 4,5-Diaminopyrimidin mit Glyoxal.[8]
Literatur
- Theophil Eicher, Siegfried Hauptmann: Chemie der Heterocyclen. Struktur, Reaktionen und Synthesen, S. 425–430, Thieme, Stuttgart, 1994. ISBN 3-13-135401-1.
- Wolfgang Pfleiderer: Neuere Entwicklungen in der Pteridin-Chemie, Angew. Chem. 75, 993–1014 (1963), doi:10.1002/ange.19630752102.
Einzelnachweise
- ↑ a b c d Eintrag zu Pteridine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Mai 2014.
- ↑ Adrien Albert, D. J. Brown, Gordon Cheeseman: Pteridine studies. Part I. Pteridine, and 2- and 4-amino- and 2- and 4-hydroxy-pteridines, J. Chem. Soc., 1951, 474–485; doi:10.1039/JR9510000474.
- ↑ R. C. West (Hrsg.) CRC Handbook of Chemistry and Physics, 59. Aufl., CRC Press, Palm Beach, 1978–1979.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Robert Purrmann: Über die Flügelpigmente der Schmetterlinge. VII. Synthese des Leukopterins und Natur des Guanopterins. Justus Liebigs Annalen der Chemie, 544, 182–190 (1940), doi:10.1002/jlac.19405440111.
- ↑ Robert Purrmann: Konstitution und Synthese des sogenannten Anhydroleukopterins. Über die Flügelpigmente der Schmetterlinge XII. Justus Liebigs Annalen der Chemie, 548, 284–292 (1941); doi:10.1002/jlac.19415480121.
- ↑ Clemens Schöpf, Rolf Reichert: Zur Kenntnis des Leukopterins, Justus Liebigs Annalen der Chemie, 548, 82–94 (1941), doi:10.1002/jlac.19415480108.
- ↑ Adrien Albert, D. J. Brown, Gordon Cheeseman: Pteridine studies. Part I. Pteridine, and 2- and 4-amino- and 2- and 4-hydroxy-pteridines, J. Chem. Soc., 1951, 474–485; doi:10.1039/JR9510000474.