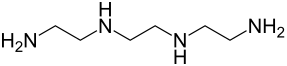
Triethylentetramin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triethylentetramin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H18N4 | ||||||||||||||||||
| Kurzbeschreibung |
ölige, gelbliche Flüssigkeit mit schwach aminartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 146,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,98 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
278 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,496–1,5[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Triethylentetramin (kurz TETA) ist eine organische chemische Verbindung aus der Gruppe der aliphatischen Amine.
Gewinnung und Darstellung
Triethylentetramin wird durch Erhitzen von Ethylendiamin[6] oder durch die Reaktion einer Ammoniaklösung mit 1,2-Dichlorethan gewonnen. Bei diesem Prozess entsteht eine ganze Familie von Ethylenaminen wie Ethylendiamin, Diethylentriamin, Triethylentetraminen, Tetraethylenpentaminen, Pentaethylenhexaminen und Aminoethylpiperazinen. Diese Polyamine entstehen als Hydrochloride und müssen neutralisiert (in der Regel mit wässriger Natronlauge) werden, um die freien Amine zu erzeugen.
Im Jahr 1990 betrug die Produktionsmenge von Triethylentetramin in Deutschland 1200 bis 1500 t pro Jahr (z. B. durch die Bayer AG), 6000 t pro Jahr in den Niederlanden, 1800 t pro Jahr in Japan und mehr als 11.000 t pro Jahr in den USA.[5] Damit zählt es zu den chemischen Substanzen, die in großen Mengen hergestellt werden („High Production Volume Chemical“, HPVC) und für die von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) eine Datensammlung zu möglichen Gefahren („Screening Information Dataset“, SIDS) angefertigt wurde.[5]
Eigenschaften
Chemische Eigenschaften
Triethylentetramin zeigt die typische Reaktivität von Aminen (ähnlich wie Ethylendiamin und Diethylentriamin).
Physikalische Eigenschaften
Beim technischen Produkt liegt der Schmelzpunkt tiefer (bis zu −35 °C) als beim reinen Stoff.[5]
TETA liegt in Form einer öligen, farblosen Flüssigkeit vor, die in technischer Reinheit durch Verunreinigungen, die durch Oxidation an Luft entstehen, meist eine gelbliche Farbe besitzt. Technisches TETA enthält bis zu 40 % Nebenprodukte in Form des verzweigten Isomeren Tris(2-aminoethyl)amin oder anderer organischer Verbindungen wie N,N′-Bis(2-aminoethyl)piperazin, N-[1-(2-Piperazin-1-yl-ethyl)]ethan-1,2-diamin oder Diethylentriamin.[5]
Verwendung
Technische Verwendung
Triethylentetramin wird zur Herstellung von Netzmitteln, Emulgatoren, Textilhilfsmitteln, Acrylatkautschuk, Amin- und Amidharzen und Additiven für Schmiermittel und Kraftstoffe (Polybutenylsuccinimide) verwendet. In großem Umfang eingesetzt wird es als Härter für Zweikomponenten-Epoxidharz-Systeme zur Imprägnierung und Beschichtung von Böden sowie zur Herstellung von Mörteln und Spachtelmassen.
Weiterhin wird es als Chelatbildner in der Komplexchemie verwendet (Abkürzung nach IUPAC trien), so bildet es beispielsweise mit zweiwertigen Kupfer-Ionen einen gut wasserlöslichen, tiefblauen Komplex. Das kann zur Komplexierung von Kupfer bei Morbus Wilson eingesetzt werden.
Therapeutische Verwendung
In der Medizin ist Triethylentetramin (internationaler Freiname Trientin) als Arzneimittel zur Behandlung von Morbus Wilson (Kupferspeicherkrankheit) zugelassen. Dabei wird die kupferkomplexierende Eigenschaft von Triethylentetramin genutzt. Darüber hinaus zeigt TETA eine anti-angiogene und Telomerase-inhibierende Wirkung, weshalb es als ein vielversprechendes potenzielles Chemotherapeutikum bei Krebserkrankungen angesehen wird.[7]
Pharmazeutisch eingesetzt wird das Trientindihydrochlorid oder -tetrahydrochlorid, kristalline Substanzen, die leicht wasserlöslich sind.[8][9] Sie werden oral verabreicht. Die am häufigsten beobachtete Nebenwirkung ist Übelkeit. Während der Behandlung können Eisenmangelanämie und Kolitis auftreten.[9]
Sicherheitshinweise
Eine Sensibilisierung und nachfolgende allergische Reaktionen der Haut sind bei Kontakt mit Triethylentetramin möglich. Die Dämpfe sind schwerer als Luft. Beim Versprühen bzw. Erwärmung über den Flammpunkt (135 °C) ist die Bildung eines explosionsfähigen Gemisch möglich.[2]
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu 3,6-Diazaoctan-1,8-diamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ a b c Datenblatt Triethylentetramin (PDF; 192 kB) bei gischem.de, abgerufen am 26. November 2019.
- ↑ Eintrag zu Triethylentetramin bei ChemBlink, abgerufen am 25. Februar 2011.
- ↑ Eintrag zu Trientine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d e OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Triethylene tetramine, abgerufen am 3. Oktober 2014.
- ↑ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi:10.1002/14356007.a02_001.
- ↑ J. Lu: Triethylenetetramine pharmacology and its clinical applications. In: Molecular Cancer Therapeutics. Band 9, Nummer 9, September 2010, S. 2458–2467. doi:10.1158/1535-7163.MCT-10-0523. PMID 20660601. (Review).
- ↑ Description Information Synprine, Stand Dezember 2016.
- ↑ a b CHMP assessment report Cuprior, April 2017.

