Chlorylfluorid
aus Wikipedia, der freien Enzyklopädie
Dies ist die aktuelle Version dieser Seite, zuletzt bearbeitet am 27. Mai 2021 um 13:12 Uhr durch imported>WikispiderBot(3723631) (⚙️ Bot: Quelltextbereinigung, prüfe und aktualisiere Vorlagen-Einbindungen).
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
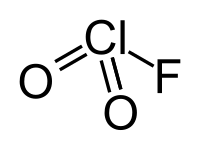
| |||||||
| Allgemeines | |||||||
| Name | Chlorylfluorid | ||||||
| Andere Namen |
Chlordioxidfluorid | ||||||
| Summenformel | ClFO2 | ||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 86,45 g·mol−1 | ||||||
| Aggregatzustand |
gasförmig[1] | ||||||
| Siedepunkt |
−6 °C[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Chlorylfluorid ist eine chemische Verbindung aus der Gruppe der Fluoride der Chlorsäure.
Gewinnung und Darstellung
Chlorylfluorid kann durch Reaktion von Chlordioxid mit Fluor bei etwa −50 °C gewonnen werden.[1]
Es wurde 1942 erstmals von Schmitz und Schumacher synthetisiert.[3]
Es kann auch durch Reaktion von Kaliumchlorat[4] oder Natriumchlorat mit Chlortrifluorid dargestellt werden.
Eigenschaften
Chlorylfluorid ist ein farbloses Gas, das sehr empfindlich gegen Feuchtigkeit ist. Es bildet an feuchter Luft sofort Nebel. Die Verbindung ist thermisch viel stabiler als Chlordioxid.[1]
Einzelnachweise
- ↑ a b c d e Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 166.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Harry Julius Emeleus, A. G. Sharpe: Advances in Inorganic Chemistry and Radiochemistry. Academic Press, 1976, ISBN 0-08-057867-5, S. 347 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, Egon Wiberg, Nils Wiberg: Inorganic Chemistry. Academic Press, 2001, ISBN 0-12-352651-5, S. 1797 (eingeschränkte Vorschau in der Google-Buchsuche).

