Bismutwolframat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
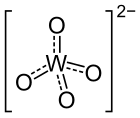
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Bismutwolframat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | Bi2(WO4)3 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 1161,48 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
8,24 g·cm−3[3] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Bismutwolframat ist eine anorganische chemische Verbindung aus der Gruppe der Wolframate.
Gewinnung und Darstellung
Bismutwolframat kann durch Reaktion von Natriumwolframat mit Bismut(III)-chlorid und Natriumchlorid oder durch Reaktion von Bismut(III)-oxid mit Wolframtrioxid gewonnen werden.[3]
Eigenschaften
Bismutwolframat ist ein geruchloser gelblicher Feststoff, der praktisch unlöslich in Wasser ist.[1] Die Verbindung kommt in zwei Modifikationen vor und besitzt entweder eine grau grüne monokline oder weiße tetragonale Kristallstruktur. Zu beachten ist, das noch zwei weitere Bismutwolframate bekannt sind (3 Bi2O3·WO3, Schmelzpunkt 1011 °C und Bi2O3·WO3, Schmelzpunkt 1064 °C).[4]
Verwendung
Bismutwolframat wird als Fotokatalysator, der im sichtbaren Licht wirksam ist, eingesetzt.[1][5]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Bismutwolframat bei AlfaAesar, abgerufen am 14. Juni 2016 (PDF) (JavaScript erforderlich).
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8 (books.google.com).
- ↑ a b c R. J. Meyer: Wolfram. Springer-Verlag, 2013, ISBN 978-3-662-13401-6 (books.google.com).
- ↑ G. D. Rieck: Tungsten and Its Compounds. Elsevier, 2013, ISBN 978-1-4832-2611-8 (books.google.com).
- ↑ Steven L. Suib: New and Future Developments in Catalysis: Catalysis for Remediation and Environmental Concerns. Newnes, 2013, ISBN 978-0-444-53871-0 (books.google.com).

