Rubidiumnitrat
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
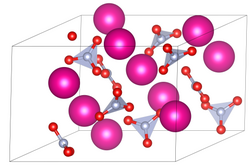
| |||||||||||||
| _ Rb+ _ N3+ _ O2− | |||||||||||||
| Kristallsystem |
trigonal | ||||||||||||
| Raumgruppe |
P31 (Nr. 144) | ||||||||||||
| Gitterparameter | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Rubidiumnitrat | ||||||||||||
| Verhältnisformel | RbNO3 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 147,47 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
3,11 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
löslich in Wasser: 442,8 g·l−1 (16 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Rubidiumnitrat ist das Rubidiumsalz der Salpetersäure.
Eigenschaften
Rubidiumnitrat bildet bei Raumtemperatur farblose, stark hygroskopische trigonale Kristalle und ist gut wasserlöslich. Der Brechungsindex der Kristalle beträgt nD = 1,524.[4]
| Gitterkonstanten der Modifikationen von Rubidiumnitrat | ||||||||
| Bezeichnung | Temperaturbereich [°C] |
Kristallsystem | Raumgruppe | a [pm] | b [pm] | c [pm] | β | Z |
|---|---|---|---|---|---|---|---|---|
| RbNO3 – IV[1][5] | < 164 | trigonal | P31 (Nr. 144) | 1047 | - | 745 | – | 4 |
| RbNO3 – III[6][5] | 164 – 220 | kubisch | Pm3m (Nr. 221) | 440 | - | - | – | 1 |
| RbNO3 – II[5][7] | 220 – 291 | rhombisch | R3m (Nr. 160) | 548 | - | 1071 | – | |
| RbNO3 – I[8][9] | > 291 | kubisch | Fm3m (Nr. 225) | 732 | - | - | – | 4 |
Es weist eine rotviolette Flammenfärbung auf. Es ist ein starkes Oxidationsmittel und zersetzt sich beim Erhitzen zu Rubidiumnitrit und Sauerstoff:
Wenn man Rubidiumnitrat mit Salpetersäure behandelt, bilden sich die sauren Nitrate RbH(NO3)2 (Schmelzpunkt 62 °C) und RbH2(NO3)3 (Schmelzpunkt 39–46 °C).[10]
Darstellung (Herstellung)
Rubidiumnitrat kann durch Salzbildungsreaktion mit Salpetersäure aus Rubidiumhydroxid oder auch aus elementarem Rubidium hergestellt werden:
Verwendung
Rubidiumnitrat wird als Bestandteil von infrarot-emittierenden Leuchtmitteln zusammen mit anderen Alkalinitraten als Oxidationsmittel eingesetzt.[11]
Einzelnachweise
- ↑ a b Jutta Pohl, Dieter Pohl, Gunadi Adiwidjaja: Phase Transition in Rubidium Nitrate at 346 K and Structure at 296, 372, 413 and 437 K. In: Acta Crystallographica Section B. B48, 1992, S. 160–166, doi:10.1107/S0108768191013459 (Open Access).
- ↑ a b c d Datenblatt Rubidiumnitrat bei Acros, abgerufen am 20. Februar 2010..
- ↑ a b c Datenblatt Rubidium nitrate bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale. 4. Auflage. Band 3. Springer, 1997, ISBN 978-3-540-60035-0, S. 690 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c R. N. Brown, A. C. McLaren: The Thermal Transformations in Solid Rubidium Nitrate. In: Acta Crystallographica. Band 15, 1962, S. 974–976, doi:10.1107/S0365110X62002583 (Open Access).
- ↑ M. Shamsuzzoha, B. W. Lucas: Single-Crystal (Neutron) Diffraction Structure of III-Rubidium Nitrate. In: Acta Crystallographica Section C. C43, 1987, S. 385–388, doi:10.1107/S0108270187095660 (Open Access).
- ↑ V. I. Nasirov, U. G. Asadov, А. F. Haziyeva, F. G. Magerramova: Kinetics of IV->III Polymorphous Transformation in Rb0,95Cs0,05NO3 Single Crystals. In: Fizika (Baku). Band 15, Nr. 4, 2009, S. 27–29 (gov.az [PDF; 206 kB]).
- ↑ K. O. Strømme: On the Crystal Structures of the High-temperature Phases of Rubidium Nitrate, Cesium Nitrate, and Thallium Nitrate. In: Acta Chemica Scandinavica. Band 25, Nr. 1, 1971, S. 211–218, doi:10.3891/acta.chem.scand.25-0211.
- ↑ J. Liu, C.-G. Duan, M. M. Ossowski, W. N. Mei, R. W. Smith, J. R. Hardy: Molecular Dynamics Simulation of Structural Phase Transitions in RbNO3 and CsNO3. In: Journal of Solid State Chemistry. Band 160, Nr. 1, August 2001, S. 222–229, doi:10.1006/jssc.2001.9226.
- ↑ R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Band 2. S. Hirzel Verlag, 1908, S. 435 (archive.org).
- ↑ Patent DE69333292: Komprimierbare Infrarot-Beleuchtungszusammensetzungen. Veröffentlicht am 13. Mai 2004, Erfinder: Daniel B. Nielson.





