Rubidiumsulfat
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
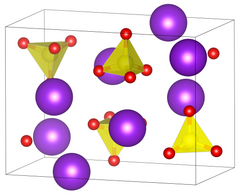
| |||||||||||||
| _ Rb+ _ S6+ _ O2− | |||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | ||||||||||||
| Gitterparameter |
a = 780.1 pm, b = 596.5 pm, c = 1041.6 pm | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Rubidiumsulfat | ||||||||||||
| Verhältnisformel | Rb2SO4 | ||||||||||||
| Kurzbeschreibung |
weiße geruchlose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 266,9 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
3,613 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
1700 °C[1] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
−1443 kJ/mol[6] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Rubidiumsulfat ist das Rubidiumsalz der Schwefelsäure.
Herstellung
Rubidiumsulfat kann durch Salzbildungsreaktion aus Rubidiumhydroxid und Schwefelsäure hergestellt werden.
Auch aus Rubidiumcarbonat ist die Synthese möglich.
Eigenschaften
Physikalische Eigenschaften
Rubidiumsulfat kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 780.1 pm, b = 596.5 pm, c = 1041.6 pm, und 4 Formeleinheiten pro Elementarzelle.[2] Die Kristalle sind mit den Kristallen von Kaliumsulfat isomorph.[7] Bei 657 °C wandelt es sich in eine andere Modifikation um.[7] Die Wasserlöslichkeit der Substanz nimmt mit steigender Temperatur zu, so lösen sich bei 0 °C 364 g und bei 100 °C 826 g Rubidumsulfat in 1 l Wasser.[7]
Die Standardbildungsenthalpie von Rubidiumsulfat beträgt −1443 kJ/mol, die Lösungswärme beträgt 27,88 kJ/mol.[6]
Chemische Eigenschaften
Durch elektrolytische Oxidation entsteht aus einer gesättigten Lösung von Rubidiumsulfat und Schwefelsäure bei niedriger Temperatur das Rubidiumpersulfat Rb2S2O8.[7]
Einzelnachweise
- ↑ a b c d Datenblatt Rubidiumsulfat bei AlfaAesar, abgerufen am 24. Juni 2010 (PDF) (JavaScript erforderlich).
- ↑ a b c d Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale. 4. Auflage. Band 3. Springer, 1997, ISBN 978-3-540-60035-0, S. 692 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt Rubidiumsulfat bei Acros, abgerufen am 24. Juni 2010.
- ↑ Datenblatt Rubidium sulfate bei Sigma-Aldrich, abgerufen am 9. Mai 2017 (PDF).
- ↑ a b Datenblatt Rubidium sulfate (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- ↑ a b M. de Forcrand: Sur les chlorures et sulfates de rubidium et de caesium. In: Compt. Rend. Hebd. Band 143, 1906, S. 98 (Volltext).
- ↑ a b c d R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Band 2. S. Hirzel, 1908, S. 431 (Volltext).

