Diiodhexaoxid
| Kristallstruktur | |||
|---|---|---|---|
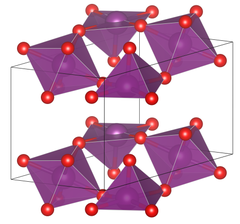
| |||
| _ I _ O | |||
| Kristallsystem |
triklin | ||
| Raumgruppe |
P1 (Nr. 2)[1] | ||
| Gitterparameter |
a = 5,006 Å, b = 6.741 Å, c = 6,795 Å, α = 97.1°, β = 96.43°, γ = 105.36°[1] | ||
| Allgemeines | |||
| Name | Diiodhexaoxid | ||
| Verhältnisformel | I2O6 | ||
| Kurzbeschreibung |
gelber Feststoff[2] | ||
| Externe Identifikatoren/Datenbanken | |||
| |||
| Eigenschaften | |||
| Molare Masse | 349,805 g·mol−1 | ||
| Aggregatzustand |
fest | ||
| Dichte |
4,53 g·cm−3 [1] | ||
| Schmelzpunkt |
150 °C (Zersetzung)[3] | ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Diiodhexaoxid ist eine anorganische Verbindung, die als Iodoxid zu den Halogenoxiden gehört.
Darstellung
Die Darstellung von Diiodhexaoxid kann durch vielfältige Wege erfolgen. Möglich ist die Entwässerung von Periodsäure mittels konzentrierter Schwefelsäure:
- .
Alternativ kann die Darstellung durch Reaktion von Periodsäure mit Iodsäure mit Schwefelsäure erfolgen.
Die thermische Zersetzung von meta-Periodsäure im Vakuum führt ebenfalls zur Darstellung von Diiodhexaoxid.[3][5]
Eigenschaften
Unter 100 °C kann Diiodhexaoxid stabil unter Feuchtigkeitsausschluss gelagert werden. Beim Lösen in Wasser findet eine exotherme Reaktion zu Iod- und Periodsäure statt. Bei Erhitzen über 150 °C kann die Zersetzung in Diiodpentoxid beobachtet werden;[3]
- .
Die Verbindung ist diamagnetisch, was auf die unterschiedlichen Oxidationszahlen der Iodatome zurückgeführt wird.[5] Als Festkörper kristallisiert die Verbindung in der Raumgruppe P1 (Raumgruppen-Nr. 2) mit den Gitterkonstanten a = 500,6 pm, b = 674,1 pm, c = 679,5 pm, α = 97.1°, β = 96.43°, γ = 105.36° mit einer Formeleinheit pro Elementarzelle.[1]
Einzelnachweise
- ↑ a b c d Thorsten Kraft, Martin Jansen: Synthesis and Crystal Structure of Diiodine(V/VII) Hexaoxide: An Intermediate between a Molecular and a Polymer Solid. In: J. Am. Chem. Soc. Band 117, Nr. 25, Juni 1995, S. 6795–6796, doi:10.1021/ja00130a026.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 96. Auflage. CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-67.
- ↑ a b c A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 543–544 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Hans Siebert, Manfred Weise, Ursula Woerner: Über das Jod(V,VII)-oxid J2O6. In: Z. anorg. allg. Chem. Band 432, Nr. 1, Juli 1977, S. 136–140, doi:10.1002/zaac.19774320117.
![{\displaystyle \mathrm {H_{5}IO_{6}\ {\xrightarrow[{-H_{2}O}]{H_{2}SO_{4}}}\ I_{2}O_{6}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/018fba39c320a309304d6841f7bb2d8487be683d)

![{\displaystyle {\ce {2I2O6 ->[\Delta T] 2I2O5 + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aaa70f9689e41dd30d99258010cb7db8192dd6a8)