Cobalt(II)-fluorid
aus Wikipedia, der freien Enzyklopädie
Dies ist die aktuelle Version dieser Seite, zuletzt bearbeitet am 30. Oktober 2021 um 14:11 Uhr durch imported>CactusBot(683007) (Bot: Strukturhinweis: syntaktische Aktualisierung).
| Kristallstruktur | ||||||||
|---|---|---|---|---|---|---|---|---|
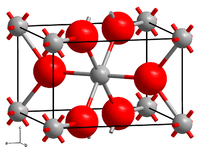
| ||||||||
| _ Co2+ _ F− | ||||||||
| Kristallsystem |
tetragonal[1] | |||||||
| Raumgruppe |
P42/mnm (Nr. 136)[1] | |||||||
| Gitterparameter |
a = 469,50(7) pm | |||||||
| Koordinationszahlen |
Co=3, F=6 | |||||||
| Allgemeines | ||||||||
| Name | Cobalt(II)-fluorid | |||||||
| Andere Namen |
Cobaltdifluorid | |||||||
| Verhältnisformel | CoF2 | |||||||
| Kurzbeschreibung |
rosenroter Feststoff[2] | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 96,93 g·mol−1 | |||||||
| Aggregatzustand |
fest | |||||||
| Dichte | ||||||||
| Schmelzpunkt | ||||||||
| Siedepunkt |
1400 °C[5] | |||||||
| Löslichkeit | ||||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Toxikologische Daten | ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Cobalt(II)-fluorid ist eine chemische Verbindung des Cobalts aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Cobalt(II)-fluorid kann durch Reaktion von Cobalt(II)-chlorid oder Cobalt(II)-carbonat[8] mit Fluorwasserstoff gewonnen werden.[2]
Eigenschaften
Cobalt(II)-fluorid ist ein rosenroter Feststoff, der wenig löslich in Wasser ist. Er besitzt eine Kristallstruktur vom Rutil-Typ[2] und kommt auch als Di-, Tri- und Tetrahydrat vor.
Verwendung
Cobalt(II)-fluorid kann als Katalysator zur Herstellung von Perfluorcarbonen verwendet werden.[9]
Einzelnachweise
- ↑ a b c M. M. R. Costa, J. A. Paixão, M. J. M. de Almeida, L. C. R. Andrade: Charge densities of two rutile structures: NiF2 and CoF2. In: Acta crystallographica. Section B, Structural science. Band 49, Nr. 4, 1993, S. 591–599, doi:10.1107/S0108768193001624.
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 275.
- ↑ a b c Datenblatt Cobalt(II) fluoride, powder bei Sigma-Aldrich, abgerufen am 16. Januar 2012 (PDF).
- ↑ Datenblatt Cobalt(II) fluoride tetrahydrate, 99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 16. Januar 2012 (PDF).
- ↑ a b Webelements: Cobalt difluoride
- ↑ R. H. Carter: Solubilities of Some Inorganic Flurides in Water at 25 °C. In: Industrial & Engineering Chemistry. Band 20, Nr. 11, 1928, S. 1195, doi:10.1021/ie50227a024.
- ↑ G.J.A. Speijers, E.I. Krajnc, J.M. Berkvens, M.J. van Logten: Acute oral toxicity of inorganic cobalt compounds in rats. In: Food and Chemical Toxicology. Band 20, Nr. 3, Juni 1982, S. 311–314, doi:10.1016/S0278-6915(82)80298-6.
- ↑ Eintrag zu Cobaltous fluoride in der Hazardous Substances Data Bank, abgerufen am 27. Juli 2012 (online auf PubChem).
- ↑ A.K. Srivastava, P.C. Jain: Chemistry. 2008, ISBN 81-88597-83-X, S. 827 (eingeschränkte Vorschau in der Google-Buchsuche).



