Siliciumdisulfid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| _ Si4+ _ S2− | |||||||||||||
| Raumgruppe |
Ibam (Nr. 72) | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Siliciumdisulfid | ||||||||||||
| Andere Namen |
Silicium(IV)-sulfid | ||||||||||||
| Verhältnisformel | SiS2 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit Geruch nach faulen Eiern[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 92,21 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
2,02 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Siliciumdisulfid ist eine anorganische chemische Verbindung des Siliciums aus der Gruppe der Sulfide.
Vorkommen
Es wird vermutet, dass Siliciumdisulfid in zirkumstellaren Hüllen vorkommt.[2]
Gewinnung und Darstellung
Siliciumdisulfid kann durch Reaktion von Siliciumdioxid mit Aluminiumsulfid bei 1200 bis 1300 °C gewonnen werden, wobei auch Siliciummonosulfid entsteht.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von trockenem Schwefelwasserstoff mit Silicium bei 1200 bis 1300 °C oder die thermische Zersetzung von Tetraethylmercaptosilan Si(SC2H5)4 bei 250 bis 300 °C.[3] Auch beim Zusammenschmelzen der Elemente bei 1000 °C entsteht es.[4]
Eigenschaften
Siliciumdisulfid ist eine weiße, faserige Masse, die sehr feuchtigkeitsempfindlich ist und sich in Wasser, Ethanol[4] und Ammoniak[4] zersetzt.[3]
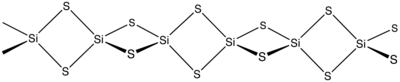
Beim Erhitzen an der Luft verbrennt es langsam.[3] Es besitzt nicht wie Siliciumdioxid eine Raumnetz-, sondern eine Faserstruktur mit verzerrt tetraedrisch koordinierten Siliciumatomen. Es ist eine verzerrt kubisch dichteste Kugelpackung in der je ein Viertel der tetraedrischer Lücken durch Siliciumatome besetzt ist.[5] Es ist eine orthorhombische Kristallstruktur mit der Raumgruppe Ibam (Raumgruppen-Nr. 72).[6] Beim Erhitzen unter Druck geht diese in eine Cristobalit-artige Modifikation über.[4]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Silicon(IV) sulfide, 95% bei AlfaAesar, abgerufen am 6. Januar 2014 (PDF) (JavaScript erforderlich).
- ↑ Goebel, J. H. (1993): SiS2 in Circumstellar Shells. Astronomy and Astrophysics 278 (1): 226–230. bibcode:1993A&A...278..226G.
- ↑ a b c d Der BibISBN-Eintrag [[Vorlage:BibISBN/Skriptfehler: Das Modul gab einen nil-Wert zurück. Es wird angenommen, dass eine Tabelle zum Export zurückgegeben wird.]] ist nicht vorhanden. Bitte prüfe die ISBN und lege ggf. einen [{{fullurl:Vorlage:bibISBN/Skriptfehler: Das Modul gab einen nil-Wert zurück. Es wird angenommen, dass eine Tabelle zum Export zurückgegeben wird.|action=edit§ion=new&preload=Vorlage%3ABibISBN%2FVorlage&nosummary=1}} <span title="Vorlage:bibISBN/Skriptfehler: Das Modul gab einen nil-Wert zurück. Es wird angenommen, dass eine Tabelle zum Export zurückgegeben wird. (Seite nicht vorhanden)">neuen Eintrag] an.
- ↑ a b c d A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 916.
- ↑
- ↑