Chrom(III)-sulfid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Cr3+ _ S2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Chrom(III)-sulfid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | Cr2S3 | ||||||||||||
| Kurzbeschreibung |
brauner geruchloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 200,18 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
3,77 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Chrom(III)-sulfid ist eine anorganische chemische Verbindung des Chroms aus der Gruppe der Sulfide.
Gewinnung und Darstellung
Chrom(III)-sulfid kann durch Reaktion eines stöchiometrischen Gemischs von Chrom und Schwefel bei 1000 °C[2]
oder von Chrom(III)-chlorid oder Chrom(III)-oxid[3] mit Schwefelwasserstoff bei 650 °C gewonnen werden.[2]
Eigenschaften
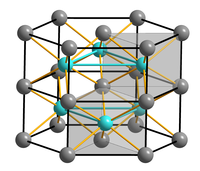
Chrom(III)-sulfid ist ein brauner geruchloser Feststoff, der unlöslich in Wasser ist.[1] Er hat eine trigonale Kristallstruktur mit der Raumgruppe P31c (Raumgruppen-Nr. 163).[4] Diese entspricht dem Nickelarsenidtyp, wobei in jeder zweiten Schicht 2/3 geordnete Leerstellen vorhanden sind.[5] Beim Schmelzen der Verbindung zersetzt sich diese unter Schwefelabgabe zu Chrom(II)-sulfid, wobei zwischenzeitlich auch weitere Phasen wie Cr3S4, Cr5S6 und Cr7S8 entstehen.[3] Chrom(III)-sulfid ist beständig gegen nichtoxidierende Säuren[2] wandelt sich aber mit oxidierenden alkalische Lösungen zu Chrom(VI)-Verbindungen um. Beim Schmelzen von Alkalisulfiden mit Chrom(III)-sulfid bilden sich Thiochromate(III).[6]
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Chrom(III) sulfide, 99% (metals basis) bei AlfaAesar, abgerufen am 29. Juni 2013 (PDF) (JavaScript erforderlich).
- ↑ a b c d Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1493.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1451.
- ↑ Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 406 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022566-2, S. 732 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994, ISBN 3-11-011451-8, S. 225 (eingeschränkte Vorschau in der Google-Buchsuche).


