Ammoniumhydrogensulfat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
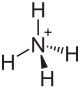 
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ammoniumhydrogensulfat | ||||||||||||
| Andere Namen |
Ammoniumbisulfat | ||||||||||||
| Summenformel | NH4HSO4 | ||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 115,10 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,79 g·cm−3 (bei 20 °C)[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
leicht in Wasser (115,1 g·l−1 bei 20 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Ammoniumhydrogensulfat ist ein Ammoniumsalz der Schwefelsäure. Es besitzt die Formel NH4HSO4.
Gewinnung und Darstellung
Ammoniumhydrogensulfat entsteht bei Zersetzung von Ammoniumsulfat bei Temperaturen über 100 °C, wobei Ammoniak frei wird. Ammoniumhydrogensulfat entsteht in großen Mengen als Abscheidungsprodukt in Aktivkoks-Filteranlagen für Schwefeldioxid-haltige industrielle Abgase. Die Filter werden mit Sauerstoff, Ammoniak und Wasserdampf beschickt, wobei über Schwefelsäure das Hydrogensulfat und auch Ammoniumsulfat entstehen:[3]
Eigenschaften
Ammoniumhydrogensulfat bildet weiße, monokline, hygroskopische Kristalle.[4] Die Substanz zersetzt sich bei Temperaturen über 120 °C, wobei Schwefeloxide, Stickoxide und Ammoniak frei werden. Die Lösung von 100 g Ammoniumhydrogensulfat in 1 l Wasser zeigt bei 20 °C einen pH-Wert von 1,[2] liegt also im stark sauren Bereich.
Verwendung
Verwendung findet es zur Herstellung von Ammoniumperoxodisulfat,[5] als Zusatzstoff in Stickstoffdünger,[6] zur Bekämpfung von Waldbränden als viskose Lösung/Suspension in Wasser und zur Herstellung von Ammoniumalaun und Flammschutzmitteln für Cellulose-Produkte.[1]
Sicherheitshinweise
Ammoniumhydrogensulfat ist als schwach wassergefährdend (WGK 1) eingestuft.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Ammoniumhydrogensulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b Datenblatt Ammoniumhydrogensulfat (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ Heinz Brauer (Hrsg.): Handbuch des Umweltschutzes und der Umweltschutztechnik: Band 3: additiver Umweltschutz: Behandlung von Abluft und Abgasen. Springer, 1996, ISBN 9783540580607, S. 577.
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale. 4. Auflage, Springer, 1997, ISBN 9783540600350, S. 596.
- ↑ Arnold Willmes: Taschenbuch chemische Substanzen: Elemente - Anorganika - Organika - Naturstoffe - Polymere. 3. Auflage, Harri Deutsch Verlag, 2007, ISBN 9783817117871, S. 115.
- ↑ Patentanmeldung DE4126806A1: Verfahren zur Herstellung von granuliertem Ammoniumsulfat. Angemeldet am 9. August 1991, veröffentlicht am 11. Februar 1993, Anmelder: Leuna Werke AG, Erfinder: Wolfgang Ermischer et al.



