Samarium(II)-chlorid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Sm2+ _ Cl− | |||||||||||||
| Kristallsystem | |||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | ||||||||||||
| Gitterparameter |
a = 900,9 pm, b = 756,2 pm, c = 450,7 pm[1] | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Samarium(II)-chlorid | ||||||||||||
| Andere Namen |
Samariumdichlorid | ||||||||||||
| Verhältnisformel | SmCl2 | ||||||||||||
| Kurzbeschreibung |
dunkelbrauner Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 221,27 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Dichte |
3,69 g·cm−3[3] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
1310 °C[2] | ||||||||||||
| Löslichkeit |
löslich in Tetrahydrofuran[4] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
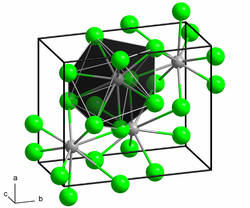
Samarium(II)-chlorid ist eine anorganische chemische Verbindung des Samariums aus der Gruppe der Chloride und kristallisiert in der PbCl2-Struktur.
Gewinnung und Darstellung
Samarium(II)-chlorid kann durch Reduktion von Samarium(III)-chlorid mit Samarium im Vakuum bei 800 bis 900 °C oder Wasserstoff bei 350 °C gewonnen werden, wobei jedoch letztere Reaktion lange Reaktionszeiten erfordert und unerwünschte Nebenreaktionen auftreten.[2]
Auch die Darstellung durch Reduktion des Samarium(III)-chlorid mit Zink in einem Schmelzfluss aus Zink(II)-chlorid bei 500 °C ist möglich.[2]
Die Verbindung lässt sich auch durch Reduktion mit Lithium-Naphthalin gewinnen.[6] Andere Reduktionsmittel wie Natrium oder Magnesium[7] können ebenfalls verwendet werden.
Eigenschaften
Samarium(II)-chlorid ist ein dunkelbrauner Feststoff. Die Verbindung ist äußerst hygroskopisch und kann nur unter sorgfältig getrocknetem Schutzgas oder im Hochvakuum aufbewahrt und gehandhabt werden. An Luft oder bei Kontakt mit Wasser geht er unter Feuchtigkeitsaufnahme in Hydrate über, die aber instabil sind und sich mehr oder weniger rasch unter Wasserstoff-Entwicklung in Oxidchloride verwandeln. Die Verbindung besitzt eine Kristallstruktur vom Blei(II)-chlorid-Typ.[2] Oberhalb von 680 °C existiert auch eine kubische Modifikation.[4]
Verwendung
Samarium(II)-chlorid wird (wie auch Samarium(II)-iodid und Samarium(II)-bromid) in der organischen Chemie zum Beispiel für Pinakol-Kupplungsreaktionen verwendet.[8]
Einzelnachweise
- ↑ G. Meier und Th. Schleid: The metallothermic reduction of several rare-earth trichlorides with lithium and sodium. In: Journal of the Less-Common Metals 116, 1986, S. 187–197, doi:10.1016/0022-5088(86)90228-6.
- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1081.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–86 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 0-412-30120-2, S. 2903 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Kurt Rossmanith: Herstellung der klassischen Seltenerd(II)-chloride in Lösung. In: Monatshefte für Chemie. 110, 1979, S. 109–114, doi:10.1007/BF00903752.
- ↑ Advances in Inorganic Chemistry and Radiochemistry. Academic Press, 1977, ISBN 0-08-057869-1, S. 9 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David J. Procter, Robert A. Flowers, Troels Skrydstrup: Organic Synthesis Using Samarium Diiodide: A Practical Guide. Royal Society of Chemistry, 2010, ISBN 1-84755-110-6, S. 157 (eingeschränkte Vorschau in der Google-Buchsuche).


