Corey-Seebach-Reaktion
Die Corey-Seebach-Reaktion – benannt nach Elias James Corey Jr. und Dieter Seebach – ist eine Namensreaktion aus dem Bereich der Organischen Chemie. Dabei werden Aldehyde oder Ketone aus Formaldehyd oder anderen Aldehyden synthetisiert. Als Besonderheit findet dabei eine vorübergehende Umpolung einer Carbonylgruppe statt.
Übersicht
Ein Aldehyd (R1= organischer Rest) wird nacheinander umgesetzt mit Propan-1,3-dithiol, mit n-Butyllithium deprotoniert und einem Elektrophil (z. B. einem Halogenalkan) alkyliert. Letztendlich dient die Corey-Seebach-Reaktion meist der Synthese eines Ketons (R1,R2= organische Reste):[1]
Mit einer entsprechenden Wahl der Reste R1 und R2 kann mit dieser Reaktion alternativ Formaldehyd (R1 = H) zu einem anderen Aldehyd (R1 = H; R2= organischer Rest) umgesetzt werden.
Mechanismus
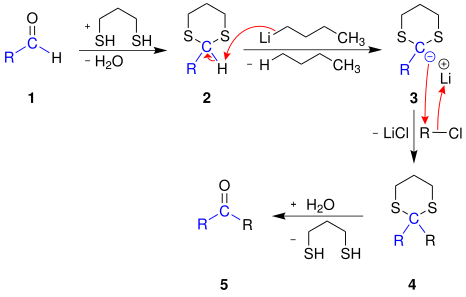
Vorschlag für den Reaktionsmechanismus zur Synthese eines Ketons 5 aus einem Aldehyd 1:[2]
Der Aldehyd 1 wird mit Propan-1,3-dithiol und einer Lewis-Säure zu einem cyclischen Dithioacetal 2 umgesetzt. Dabei ändert sich die Acidität des am Kohlenstoff gebundenen Wasserstoffatoms, dieses lässt sich nun mit der starken Base n-Butyllithium abspalten. Das so entstandene Carbanion 3 ist ein starkes Nucleophil und reagiert mit einem Chloralkan (Elektrophil) zu dem Dithioacetal 4. Um die Carbonylgruppe wiederzugewinnen, wird das Dithioacetal 4 mit Quecksilber(II)-chlorid, Calciumcarbonat und wässriger Aceton-Lösung zum Keton 5 umgesetzt. Dabei wird das Propan-1,3-dithiol wieder abgespalten.[2]
Praktische Bedeutung
Die Corey-Seebach-Reaktion ist ein reines Laborverfahren und hat keine industrielle Bedeutung. Wegen der Bildung stöchiometrischer Mengen mehrerer Abfallstoffe ist die Atomökonomie dieser Reaktion so schlecht, dass eine technische Synthese basierend auf dieser Reaktion nicht wirtschaftlich ist. Hinzu kommt die stöchiometrische Verwendung von giftigem Quecksilber(II)-chlorid im dritten Reaktionsschritt (Spaltung des Dithioacetals).
Varianten
Wird das Carbanion 3 statt mit einem Halogenalkan mit anderen Elektrophilen umgesetzt, können nach dem Prinzip der Corey-Seebach-Reaktion auch andere Produkte erhalten werden.[3]
Beispiele:
Das Carbanion 3 wird mit einem Oxiran zu einem β-Hydroxyketon 5a umgesetzt:[2]
Das Carbanion 3 wird mit einem Keton zu einem α-Hydroxyketon 5b umgesetzt:[2]
Das Carbanion 3 wird mit einem Carbonsäurehalogenid zu einem 1,2-Diketon 5c umgesetzt: [2]
Der Reaktionsmechanismus zu diesen Reaktionen verläuft analog zu dem Mechanismus zur Umsetzung mit Halogenalkanen (s. o.).
Literatur
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 384–385.
Einzelnachweise
- ↑ Reinhard Brückner: Reaktionsmechanismen, Spektrum Akademischer Verlag, 3. korrigierte Auflage, 2007, S. 384–385, ISBN 978-3-8274-1579-0.
- ↑ a b c d e Portal für Organische Chemie: Beitrag zur Corey-Seebach-Reaktion, abgerufen am 26. Juli 2013.
- ↑ Bradford P. Mundy, Michael G. Ellert, Frank G. Favaloro, Jr.: Name Reactions in Organic Synthesis, Wiley & Sons, 2. Auflage, 2005, S. 186–187, ISBN 0-471-22854-0.