Delphinidin-3-O-glucosid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Allgemeines | |||||||
| Name | Delphinidin-3-O-glucosid | ||||||
| Andere Namen |
| ||||||
| Summenformel |
| ||||||
| Kurzbeschreibung |
schwarzer Feststoff (Chlorid)[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 465,4 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Toxikologische Daten | |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Delphinidin-3-O-glucosid ist ein Pflanzenfarbstoff aus der Gruppe der Anthocyane, deren Vertreter verschiedenen Blüten und Früchten ihre rote oder blaue Färbung geben. Die chemische Verbindung besteht aus dem Aglykon Delphinidin und dem Kohlenhydrat (Zucker) Glucose, welche glycosidisch verknüpft sind.
Vorkommen
In der Pflanzenwelt ist das Glycosid als Kation weit verbreitet. Das zugehörige Anion leitet sich von verschiedenen Fruchtsäuren ab.
Unter anderem kommt das Pigment in Heidelbeeren (Vaccinium myrtillus) vor, und wird daher auch Myrtillin genannt.[2][3] In den Blüten von Stiefmütterchen (Viola tricolor) wurde es ebenfalls entdeckt.[4] Delphinidin-3-O-glucosid wurde neben anderen Anthocyanen auch im Saft von Blutorangen (Citrus sinensis),[5][6] in der Haut verschiedener Weintrauben, z. B. Tempranillo,[7] in Schwarzen Johannisbeere (Ribes nigrum)[8] und in Granatäpfeln (Punica granatum)[9] nachgewiesen. Auch die Schalen dunkler Bohnenkerne (Phaseolus vulgaris L.) enthalten dieses Glucosid.[10]
Eigenschaften
Wie viele Anthocyane wirkt auch Delphinidin-3-O-glucosid als Antioxidans.[11] So reagiert es mit Radikalen („Radikalfänger“) und wird daher als Alterungsprozesse hemmend angesehen. Es inhibiert die Peroxidation von Lipidmembranen.[12] Außerdem soll es gegen kardiovaskuläre Krankheiten schützend wirken sowie die Aggregation, d. h. das „Verkleben“ von Blutplättchen hemmen; damit würde das Risiko von Thrombosen reduziert.[12] Schließlich könnte es zur Behandlung von Fettleibigkeit therapeutische Verwendung finden.[13]
Die Verbindung wurde 1927 von Allen untersucht.[14] Basierend auf seinen Studien wird Myrtillin im menschlichen Körper eine blutzuckerstabilisierende und insulinsparende Wirkung zugeschrieben.
Myrtillin verändert in Abhängigkeit vom pH-Wert seine Farbe.
Analytik
Wie bei anderen Anthocyanen dienen chromatographische Methoden zur Identifizierung des Glycosids, am Anfang die Papierchromatographie.[15] Später diente die mit spektroskopischen Methoden gekoppelte Flüssigchromatographie, u. a. die HPLC-MS zum Nachweis.[16]
Zur Reinigung und Isolierung der Verbindung wird meistens mit Salzsäure das Chlorid des Delphinidin-3-O-glucosids hergestellt (Delphinidinchlorid-3-O-glucosid,[17] Myrtillin, Myrtillin-a).
Synthese
Eine Synthese von Delphinidin-3-O-glucosid als Chlorid wurde in den 1930er Jahren in der Arbeitsgruppe des englischen Chemikers Robert Robinson durchgeführt.[18]
Biosynthese
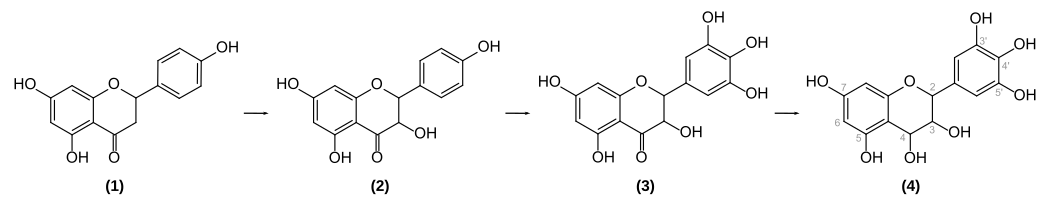
In Pflanzen wird Delphinidin-3-glucosid durch Dehydrierung und Glykosylierung von (farblosem) Leukodelphinidin (4) gebildet. Dessen Vorläufer Dihydromyricetin (3), ein Keton, wird zum tertiären Alkohol reduziert. Im Dihydromyricetin liegen die für Delphinidin charakteristischen drei Hydroxygruppen am Phenyl-Substituenten vor. Zwei davon werden aus dem Präkursor Dihydrokaempferol (2) – einem Schlüsselprodukt der Anthocyan-Synthese – durch Hydroxylierung gebildet. (1) entspricht Naringenin.[19]
Sonstiges
Das strukturell verwandte Delphinidin-3-O-galactosid ist das Empetrin (als Chlorid).[20] Das Delphinidingalactosid ohne Angabe zur Stellung der glycosidischen Bindung ist das Myrtillin-b.[21]
Literatur
T. W. Goodwin (Hrsg.): Chemistry and Biochemistry of Plant Pigments, 2. Auflage 1976, Bd. 1. Academic Press, London-New York-San Francisco. Dort vor allem T. Swain: Nature and properties of flavonoids. J. B. Harborne: Functions of flavonoids in plants.
Einzelnachweise
- ↑ a b c d e Datenblatt Delphinidin 3-O-β-D-glucoside chloride bei Sigma-Aldrich, abgerufen am 22. Mai 2017 (PDF).
- ↑ Richard Willstätter, Ernst. H. Zollinger In: Liebigs Annalen der Chemie, Jg. 1915, Bd. 408, S. 83; ebenda Bd. 412, 195 (1916).
- ↑ Ernst H. Zollinger: Über die Isolierung und die Konstitution einiger Anthocyane von Früchten und Beeren. Doktorarbeit. ETH Zürich, 1915. PDF-Datei der ETH zum Download.
- ↑ Paul Karrer, G. de Meuron, Pflanzenfarbstoffe XLVIII. Über Violanin Helvetica chimica Acta Jg. 1933, Bd. 16, S. 292. doi:10.1002/hlca.19330160141
- ↑ Silke Hillebrand, Michael Schwarz, Peter Winterhalter: Characterization of Anthocyanins and Pyranoanthocyanins from Blood Orange [Citrus sinensis (L.) Osbeck] Juice. In: J. Agric. Food Chem. Jg. 2004, Bd. 52, Heft 24, S. 7331–7338. doi:10.1021/jf0487957.
- ↑ L. Giordano, W. Coletta, P. Rapisarda, M. B. Donati, D. Rotilio: (2007), Development and validation of an LC-MS/MS analysis for simultaneous determination of delphinidin-3-glucoside, cyanidin-3-glucoside and cyanidin-3-(6-malonylglucoside) in human plasma and urine after blood orange juice administration. In: Journal of Separation Science, Jg. 2007, Bd. 30, S. 3127–3136. doi:10.1002/jssc.200700246.
- ↑ Juan Cacho, P. Fernández, V. Ferreira, J. E. Castells: Evolution of Five Anthocyanidin-3-Glucosides in the Skin of the Tempranillo, Moristel, and Garnacha Grape Varieties and Influence of Climatological Variables. In: Am. J. Enol Vitic. Jg. 1992 Bd. 43, S. 244–248
- ↑ Gordana Zdunić et al.: Black (Ribes nigrum L.) and Red Currant (Ribes rubrum L.) Cultivars. In: Monique S.J. Simmonds, Victor R. Preedy (Hrsg.): Nutritional Composition of Fruit Cultivars. Academic Press, 2016, doi:10.1016/B978-0-12-408117-8.00005-2.
- ↑ F. Hernández, P. Melgarejo, F. Tomás-Barberán et al. Evolution of juice anthocyanins during ripening of new selected pomegranate (Punica granatum) clones. In: Eur. Food Res. Technol. Jg. 1999, Bd. 210, S. 39–42. doi:10.1007/s002170050529.
- ↑ Myoung-Gun Choung, Byoung-Rourl Choi, Young-Nam An, Yong-Ha Chu, and Young-Son Cho: Anthocyanin Profile of Korean Cultivated Kidney Bean (Phaseolus vulgaris L.). In: J. Agric. Food Chem. Jg. 2003, Bd. 51, Heft 24, S. 7040–7043. doi:10.1021/jf0304021.
- ↑ Joana Azevedo, Iva Fernandes, Ana Faria, Joana Oliveira, Ana Fernandes, Victor de Freitas, Nuno Mateus, Antioxidant properties of anthocyanidins, anthocyanidin-3-glucosides and respective portisins, In: Food Chemistry, Jg. 2010, Bd. 119, Heft 2, S. 518–523. doi:10.1016/j.foodchem.2009.06.050.
- ↑ a b Y. Yang, Z. Shi, A. Reheman, J.W. Jin, C. Li, Y. Wang, et al. Plant Food Delphinidin-3-Glucoside Significantly Inhibits Platelet Activation and Thrombosis: Novel Protective Roles against Cardiovascular Diseases. In: PLoS ONE Jg. 2012, Bd. 7, Heft 5, e37323.
- ↑ M. Park, A. Sharma, H. J. Lee: Anti-adipogenic effects of delphinidin-3-O-?-glucoside in 3T3-L1 preadipocytes and primary white adipocytes. In: Molecules, Jg. 2019, mdpi.com
- ↑ Gwynn Pennant Ellis, Geoffrey Buckle West: PROGRESS IN MEDICINAL CHEMISTRY. Butterworth-Heinemann, 1961, ISBN 978-0-08-086249-1, S. 187 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ V. Jiracek, Z. Prochazka. Sauerstoffhaltige Heterocyclische Verbindungen, Flavonoide, In: I. M. Hais, K. Macek (Hrsg.) Handbuch der Papierchromatographie, 2. Aufl. 1963. Bd. 1, S. 286ff, VEB Gustav Fischer Verlag, Jena, 1963.
- ↑ L. Giordano, W. Coletta, P. Rapisarda, M. B. Donati, D. Rotilio: Development and validation of an LC-MS/MS analysis for simultaneous determination of delphinidin-3-glucoside, cyanidin-3-glucoside and cyanidin-3-(6-malonylglucoside) in human plasma and urine after blood orange juice administration. In: Journal of Separation Science, Jg. 2007, Bd. 30, S. 3127–3136. doi:10.1002/jssc.200700246.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Delphinidinchlorid-3-O-glucosid (Myrtillin): CAS-Nummer: 6906-38-3, PubChem: 165558, Wikidata: Q945655.
- ↑ T. M. Reynolds, Robert Robinson. Experiments on the synthesis of anthocyanins. Part XXI. 3-O-Glucosidyldelphinidin chloride, In: Journal of the Chemical Society Jg. 1934, S. 1039–1043. doi:10.1039/JR9340001039.
- ↑ Timothy A. Holton, Edwina C. Cornish: Genetics and Biochemistry of Anthocyanin Biosynthesis. In: The Plant Cell, Jg. 1995, Bd. 7, S. 1071–1083
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Delphinidinchlorid-3-O-galactosid: CAS-Nummer: 28500-00-7, PubChem: 176440, Wikidata: Q27262264.
- ↑ Walter Karrer: Konstitution und Vorkommen der organischen Pflanzenstoffe: exclusive Alkaloide. Springer-Verlag, 1958, S. 683 (eingeschränkte Vorschau in der Google-Buchsuche).