δ18O

δ18O bzw. Delta-O-18 ist ein Maß für das Verhältnis der stabilen Sauerstoff-Isotope 18O und 16O. Die Bestimmung des Verhältnisses ist eine Unterdisziplin der Isotopengeochemie und erfolgt unter anderem im Rahmen petrologischer, stratigraphischer oder paläoklimatologischer Untersuchungen. δ18O-Werte in bestimmten Mineralen magmatischer Gesteine geben die Temperatur des Magmas wieder, aus dem die Minerale kristallisiert sind, oder sie geben Hinweise auf Isotopenfraktionierung infolge von Reaktionen eines auskristallisierten Gesteins mit wässrigen Lösungen. δ18O-Werte in den Karbonatmineralen oder dem Opal verschiedenster Makro- und Mikrofossilien, beispielsweise Diatomeen in Süßwasserseesedimenten,[2] werden als Temperaturproxy verwendet.
Der δ18O-Wert ist definiert als:
Die Einheit ist Promille (‰, Teile pro Tausend). Der Standard hat eine bekannte Isotopenzusammensetzung wie z. B. der Vienna Standard Mean Ocean Water (VSMOW).[3]
Mechanismus und Anwendung
δ18O spiegelt auch die lokale Verdunstungsrate und den Frischwasserzustrom wider. Da aus Meerwasser bevorzugt 16O verdunstet, ist Regenwasser reich an 16O. Folglich enthält das Oberflächenwasser der Ozeane in den Subtropen größere Mengen an 18O, denn dort ist die Verdunstungsrate erhöht. Geringere Mengen an 18O gibt es im Ozeanwasser mittlerer Breitengrade, wo es mehr regnet.
Ähnliches ist bei der Kondensation zu beobachten: Wassermoleküle, die die schwereren 18O-Atome enthalten, neigen dazu, als erste zu kondensieren und auszuregnen. Der Gradient der Wasserfeuchte zeigt von den Tropen zu den Polen eine Abnahme des 18O-Gehalts. Schnee, der in Kanada fällt, enthält weniger H218O als Regen, der in Florida niedergeht; dementsprechend trägt Schnee, der im Zentrum einer Eisfläche fällt, eine leichtere δ18O-Signatur als an den Rändern der Eisfläche, da das schwerere 18O zuerst abregnet. Ein Klimawandel, der die globalen Muster von Verdunstung und Niederschlag verändert, verändert aus diesem Grund das grundlegende δ18O-Verhältnis.
Diese Zusammenhänge wurden von Harold C. Urey im Jahr 1947 entdeckt und publiziert.[4] Cesare Emiliani analysierte darauf aufbauend in den 1950er Jahren in großem Umfang Bohrkerne und untergliederte anhand der gefundenen δ18O-Signaturen die erdgeschichtlichen Epochen in sogenannte Sauerstoff-Isotopenstufen.
Geeignete Proxys
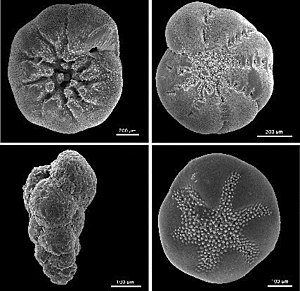
Am häufigsten wurden die Schalen von Foraminiferen untersucht. Sie bestehen aus Calciumcarbonat (CaCO3), können in vielen geologischen Strukturen gefunden werden und enthalten Sauerstoff. Das Verhältnis 18O zu 16O wird dazu benutzt, die Temperatur des umgebenden Wassers zum Kristallisationszeitpunkt indirekt zu bestimmen. Das Verhältnis schwankt in Abhängigkeit von der Temperatur des umgebenden Wassers leicht; aber auch andere Faktoren beeinflussen das Verhältnis wie z. B. der Salzgehalt und die Menge des in Eisschilden eingeschlossenen Wassers. Rekonstruktionen sind jedoch auch bei Verwendung von Korallen, Seesedimenten und Stalagmiten möglich. Daneben kann das Eis von Eisbohrkernen und der Zucker fossiler Pflanzen untersucht werden.
Während die Eignung von δ18O aus Eisbohrkernproben zur Rekonstruktion von Temperaturen vergangener Zeiten vielfach belegt ist,[5] kann es bei einer Temperaturrekonstruktion, bei der biogenes Phosphatmaterial wie z. B. Knochen- und Zahnmaterial verwendet wird, zu Verfälschungen durch Diagenese kommen.[6]
Analyse von Zucker
In den Zuckern (Arabinose, Xylose und Fucose) von in Seesedimenten abgelagerten Pflanzen ist mit Hilfe eines neuen Verfahrens ebenfalls eine klare δ18O-Signatur erkennbar, die wahrscheinlich die lokale Temperatur bzw. Niederschlagssituation widerspiegelt. In der Himalaya-Region kann diese Signatur beispielsweise als Proxy für Intensität und Variabilität des Sommermonsuns genutzt werden.[7]
Überprüfung von Lebensmitteln
Eine weitere Anwendung ist die Überprüfung der Echtheit von Lebensmitteln. Da aufgenommenes Wasser von Pflanzen in Wasser eingelagert wird, trägt jedes pflanzliche Lebensmittel in dem in ihm enthaltenen Wasser die Signatur seines Wachstumsortes. Wird beispielsweise Wein mit Leitungswasser verdünnt oder Saft, der zuvor für einen kostengünstigen Transport in ein Konzentrat verwandelt wurde, mit Leitungswasser rückverdünnt, so ist dies über die Bestimmung von δ18O nachweisbar. Liegen ausreichend genaue Daten über ein Anbaugebiet vor, so ist es mit dem Verfahren möglich, auch Angaben zum Anbauort zu überprüfen. Es ist beispielsweise überprüfbar, ob ein Bordeaux-Wein auch tatsächlich von Trauben stammt, die im Bordeaux wuchsen.[8]
Magmatische und kristalline Gesteine
Auch in magmatischen Gesteinen kann eine δ18O-Signatur Aufschluss über Herkunft und Werdegang des Materials geben. Die Variationen sind aber wegen der hohen Temperaturen der Prozesse sehr klein (im Bereich von 0,1 ‰). Die Messungen während der Analysen müssen daher mit hoher Präzision erfolgen.[9][10][11]
Berechnungen
Wenn der Einfluss wechselnder Salinität und Eisvolumens außer Acht gelassen werden und das Signal folglich ausschließlich auf Temperaturveränderungen zurückgeführt wird, entspricht ein Anstieg des δ18O um 0,22 ‰ einer Abkühlung um 1 K.[12]
Ebenso kann die Temperatur mit Hilfe dieser Gleichung berechnet werden:
Während des Pleistozän korrelierte eine δ18O-Signatur von 0,11 ‰ mit einer Meeresspiegeländerung um 10 m, die aus der Veränderung des Eisvolumens resultierte.
Siehe auch
Literatur
- Clark, I.D. and Fritz, P: Environmental Isotopes in Hydrogeology. CRC Press, 1997, ISBN 1-56670-249-6.
- Schmidt, G.A.: Forward Modeling of Carbonate Proxy Data from Planktonic Foraminifera Using Oxygen Isotope Tracers in a Global Ocean Model. In: Paleoceanography. 14, Nr. 4, 1999, S. 482–497. bibcode:1999PalOc..14..482S. doi:10.1029/1999PA900025.
Einzelnachweise
- ↑ Lorraine E. Lisiecki, Maureen E. Raymo: A Pliocene-Pleistocene stack of 57 globally distributed benthic δ18O records. In: Paleoceanography. 20, Nr. 1, März 2005, S. n/a–n/a. ISSN 0883-8305. doi:10.1029/2004PA001071.
- ↑ Melanie J Leng, Jom D Marshall: Palaeoclimate interpretation of stable isotope data from lake sediment archives. In: Quaternary Science Reviews. 23, Nr. 7–8, April 2004, S. 811–831. doi:10.1016/j.quascirev.2003.06.012.
- ↑ USGS -- Isotope Tracers -- Resources -- Isotope Geochemistry. Abgerufen am 18. Januar 2009.
- ↑ Harold C. Urey: The thermodynamic properties of isotopic substances. In: Journal of the Chemical Society (Resumed). 1947, S. 562. ISSN 0368-1769. doi:10.1039/JR9470000562.
- ↑ J. Jouzel, Richard B. Alley, K. M. Cuffey, Willi Dansgaard, P. Grootes, G. Hoffmann, S. J. Johnsen, R. D. Koster, D. Peel, C. A. Shuman, M. Stievenard, M. Stuiver, J. White: Validity of the temperature reconstruction from water isotopes in ice cores. In: Journal of Geophysical Research: Oceans. 102, Nr. 26471 – 26487, September 2012. doi:10.1029/97JC01283.
- ↑ Z. D. Sharp, V. Atudorei and H. Furrer: The effect of diagenesis on oxygen isotope ratios of biogenic phosphates. In: American Journal of Science. 300, Nr. 3, März 2000, S. 222–237. doi:10.2475/ajs.300.3.222.
- ↑ Michael Zech, Mario Tuthorn, Roland Zech, Frank Schlütz, Wolfgang Zech, Bruno Glaser: A 16-ka δ18O record of lacustrine sugar biomarkers from the High Himalaya reflects Indian Summer Monsoon variability. In: Journal of Paleolimnology. 50, Nr. 2, August 2013, S. 1–11. doi:10.1007/s10933-013-9744-4.
- ↑ Redaktion LGL: Stabilisotopenanalytik. In: Lebensmittelkennzeichnung, Täuschungsschutz. Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit. 22. März 2012. Abgerufen am 6. Juli 2013.
- ↑ Ilya Bindeman: Oxygen Isotopes in Mantle and Crustal Magmas as Revealed by Single Crystal Analysis. In: Reviews in Mineralogy & Geochemistry. Band 69, Nr. 1, 2008, S. 445–478, doi:10.2138/rmg.2008.69.12 (alternativer Volltextlink: pages.uoregon.edu).
- ↑ John W. Valley, Ilya N. Bindeman, William H. Peck: Empirical calibration of oxygen isotope fractionation in zircon. In: Geochimica et Cosmochimica Acta. Band 67, Nr. 17, 2003, S. 3257–3266, doi:10.1016/S0016-7037(03)00090-5 (alternativer Volltextlink: geology.wisc.edu).
- ↑ Claire E. Bucholz, Oliver Jagoutz, Jill A. VanTongeren, Jacob Setera, Zhengrong Wang: Oxygen isotope trajectories of crystallizing melts: Insights from modeling and the plutonic record. In: Geochimica et Cosmochimica Acta. Band 207, 2017, S. 154–184, doi:10.1016/j.gca.2017.03.027 (alternativer Volltextlink: DSpace@MIT, ungelayoutetes Manuskript).
- ↑ Visser, K., Robert Thunell, Lowell Stott: Magnitude and timing of temperature change in the Indo-Pacific warm pool during deglaciation. In: Nature. 421, Nr. 6919, 2003, S. 152. doi:10.1038/nature01297.


