Iodtrimethylsilan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Iodtrimethylsilan | |||||||||||||||
| Andere Namen |
Trimethylsilyliodid | |||||||||||||||
| Summenformel | C3H9ISi | |||||||||||||||
| Kurzbeschreibung |
orangefarbene bis bräunliche Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 200,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,47 g·cm−3[1] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
Zersetzung mit Wasser[1] | |||||||||||||||
| Brechungsindex |
1,471[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Iodtrimethylsilan ist eine chemische Verbindung. Sie besteht aus einem zentralen Siliciumatom, das nahezu tetraedrisch von drei Methylresten und einem Iodsubstituenten umgeben ist.
Herstellung
Iodtrimethylsilan kann in einer Finkelstein-ähnlichen Reaktion durch die Umsetzung von Chlortrimethylsilan mit Natriumiodid[3] oder Magnesiumiodid[4] erhalten werden.
Eine weitere Möglichkeit besteht in der Spaltung von Hexamethyldisilan[5] oder Hexamethyldisiloxan[6] durch Iod.
Eigenschaften
Iodtrimethylsilan ist eine orangefarbene bis bräunliche Flüssigkeit, die bei 107 °C siedet.[1]
Verwendung
Iodtrimethylsilan kann zur Synthese von Eschenmosersalz genutzt werden. Hierzu wird es mit Tetra-N-methylmethandiamin zur Reaktion gebracht.[7]
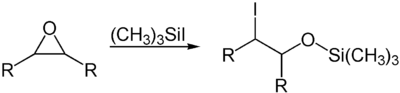
Durch seine Lewis-sauren Eigenschaften kann es auch zur Öffnung von sauerstoffhaltigen Heterocyclen genutzt werden. Ein Beispiel hierfür ist die Öffnung von Epoxiden.[8]
Einzelnachweise
- ↑ a b c d e Datenblatt Iodtrimethylsilan bei Merck, abgerufen am 27. Februar 2010.
- ↑ a b c Datenblatt Iodotrimethylsilane bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- ↑ C. Paolucci, L. Mattioli: Stereoisomeric Sugar-Derived Indolizines as Versatile Building Blocks: Synthesis of Enantiopure Di- and Tetrahydroxyindolizidines, in: J. Org. Chem., 2001, 66, S. 4787–4794; doi:10.1021/jo0016428.
- ↑ U. Krüerke: Halogen-Austausch an Chlorsilanen und die Tetrahydrofuran-Spaltung durch Brom- und Jodsilane, in: Chem. Ber., 1962, 95, S. 174–182; doi:10.1002/cber.19620950128.
- ↑ E. C. Friedrich, C. B. Abma, P. F. Vartanian: Metal-halogen bonding studies with group IV A trialkylmetal halides, in: J. Organomet. Chem., 1980, 187, S. 203–211; doi:10.1016/S0022-328X(00)81789-1.
- ↑ M. E. Jung, M. A. Lyster: Quantitative dealkylation of alkyl ethers via treatment with trimethylsilyl iodide. A new method for ether hydrolysis, in: J. Org. Chem., 1977, 42, S. 3761–3764; doi:10.1021/jo00443a033.
- ↑ T. A. Bryson, G. H. Bonitz, C. J. Reichel, R. E. Dardis: Performed Mannich salts: a facile preparation of dimethyl(methylene)ammonium iodide, in: J. Org. Chem., 1980, 45, S. 524–525; doi:10.1021/jo01291a032.
- ↑ H. Poleschner, M. Heydenreich, D. Martin: Cyclische Ether als Edukte zur Synthese von Schmetterlings-Pheromonen, in: Synthesis, 1991, 12, S. 1231–1235; doi:10.1055/s-1991-28425.