Milchsäureethylester
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Milchsäureethylester | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H10O3 | |||||||||||||||
| Kurzbeschreibung |
farblose, mild riechende Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 118,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,03 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
154 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
hydrolysiert in Wasser[2] | |||||||||||||||
| Brechungsindex |
1,4130[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Milchsäureethylester, auch als Ethyllactat und 2-Hydroxypropionsäureethylester bezeichnet, ist der Ethylester der Milchsäure.
Milchsäureethylester ist in kleinen Mengen als Aroma- bzw. Duftstoff beispielsweise in Wein und verschiedenen Früchten enthalten. Sein Geruch ist angenehm mild und wird als fruchtartig an Kokosnuss erinnernd beschrieben.
Eigenschaften
Stereoisomere
Der kommerziell erhältliche, biotechnologisch hergestellte Milchsäureethylester liegt in der L-Form vor und trägt den exakten Namen (S)-2-Hydroxypropionsäureethylester bzw. L-(−)-Milchsäureethylester. Technisch hergestellter Milchsäureethylester liegt dagegen als Racemat vor einem 1:1 Gemisch aus D-(+)-Milchsäureethylester und L-(−)-Milchsäureethylester. Dieses Gemisch wird auch DL-(±)-Milchsäureethylester genannt.
| Enantiomere von Milchsäureethylester | ||||
| Name | L-(–)-Milchsäureethylester | D-(+)-Milchsäureethylester | ||
| Andere Namen | (S)-2-Hydroxypropionsäureethylester | (R)-2-Hydroxypropionsäureethylester | ||
| Strukturformel | 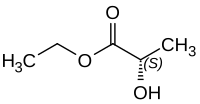
|

| ||
| CAS-Nummer | 687-47-8 | 7699-00-5 | ||
| PubChem | 92831 | 637513 | ||
| ECHA-Infocard | 100.010.632 | 100.156.709 | ||
| EG-Nummer | 211-694-1 | 628-439-9 | ||
Sicherheitstechnische Kenngrößen
Milchsäureethylester gilt als entzündliche Flüssigkeit. Oberhalb des Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei 46 °C.[2][5] Der Explosionsbereich liegt zwischen 1,5 Vol.‑% (70 g/m3) als untere Explosionsgrenze (UEG) und 11,4 Vol.‑% als obere Explosionsgrenze (OEG).[2][5] Die Grenzspaltweite wurde mit 0,99 mm bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 400 °C.[2][5] Der Stoff fällt somit in die Temperaturklasse T2.
Herstellung
Die Ausgangsstoffe zur technischen Herstellung von Milchsäureethylester sind Milchsäure und Ethanol. Beide Edukte können aus nachwachsenden Rohstoffen wie beispielsweise Mais gewonnen werden. Milchsäureethylester ist biologisch sehr gut abbaubar. Daher wächst das Interesse an diesem Lösungsmittel, das beispielsweise zum Abbeizen oder zum Reinigen von Leiterplatten in der Elektronik verwendet werden kann.[6]
Ökologische Daten
- Biologischer Abbau: 86 %/28 d, biologisch leicht abbaubar
- Eine Bioakkumulation ist nicht zu erwarten
- Fischtoxizität LC50=320 mg/l/96 h Brachidonia rerio
- Daphnientoxizität EC50=683 mg/l/48 h Daphnia magna
- Algentoxizität IC50=2200 mg/l/48 h Selenastrum capricornutum
- Chemischer Sauerstoffbedarf (CSB): 1,62 g/g[7]
Verwendung
Wegen seiner geringen Toxizität und günstigen Umwelteigenschaften[8] nimmt die Verwendung von Milchsäureethylester in sehr unterschiedlichen Bereichen stetig zu.[9] So wird er beispielsweise in pharmazeutischen Formulierungen, in Lebensmitteladditiven und Duftstoffen eingesetzt.
Photolacke in der Mikroelektronik enthalten häufig Milchsäureethylester als Lösungsmittel.[10] Dort hat sich die Bezeichnung Safer Solvent für Milchsäureethylester eingebürgert.[11]
Als Lösungsmittel wird es zum Auflösen von Nitrocellulose, Celluloseacetat und Celluloseethern verwendet.
Shampoos für Hunde und Katzen enthalten zum Teil Ethyllactat in einer waschaktiven Suspension.[12] Weitere Anwendungsmöglichkeiten bieten sich zukünftig beispielsweise im Bereich von Klebstoffen, Lebensmittelemulgatoren, als Lösungsmittel für chirale Synthesen, Farbentferner (Abbeizen) usw. Für einige Anwendungen ist derzeit der Preis von Milchsäureethylester zu hoch. Es wird jedoch intensiv an günstigeren Herstellprozessen gearbeitet.[8]
Einzelnachweise
- ↑ Eintrag zu ETHYL LACTATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- ↑ a b c d e f g h i j k l m n Eintrag zu Ethyllactat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Januar 2020. (JavaScript erforderlich)
- ↑ Eintrag zu Milchsäureester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. August 2018.
- ↑ Eintrag zu Ethyl lactate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ ADM, führender Hersteller von Ethyllactat, abgerufen am 12. Juli 2014 (Memento des Originals vom 14. Juli 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ Datenblatt Ethyllactat bei Syskem.de, abgerufen am 23. Januar 2016.
- ↑ a b Ethyl Lactate Solvents: Low-Cost and Environmentally Friendly (Memento vom 4. Dezember 2011 im Internet Archive). Argonne National Laboratory, abgerufen am 5. Juni 2007.
- ↑ ewire.com: Cargill Dow and Ashland Sign Ethyl Lactate Agreement: Green Solvents from Renewable Resources, abgerufen am 5. Juli 2007 (Memento des Originals vom 28. September 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ Herstellung von Halbleiterbauelementen (Memento vom 27. September 2011 im Internet Archive) (PDF; 575 kB).
- ↑ Fujifilm-ffem.com: HPR 500 Series, abgerufen am 5. Juli 2007.
- ↑ Lactaderm: Antibakteriell wirksames Shampoo mit Ethyllactat. (Memento des Originals vom 14. Juli 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Abgerufen am 5. Juli 2007.


