Silylether
| Trimethylsilylether und Trimethylsilylenolether |
| Strukturformel eines Trimethylsilylethers, dabei ist R ein Organyl-Rest (Alkyl-Rest, Aryl-Reste, Arylalkyl-Rest etc.), jedoch kein Wasserstoffatom. |
| Allgemeine Strukturformel eines Trimethylsilylenolethers, dabei sind R1 bis R3 Organyl-Reste (Alkyl-Reste, Aryl-Reste, Arylalkyl-Reste etc.) oder ein Wasserstoffatom. |
Silylether (auch Alkyloxysilane) sind chemische Verbindungen, die ein Siliciumatom und eine Alkoxygruppe enthalten, welche durch eine Atombindung miteinander verbunden sind. Eine wichtige Untergruppe sind die Silylenolether, die als Zwischenprodukte in der organischen Synthesechemie Verwendung finden.
Die grundlegende Struktur ist R1R2R3Si–O–R4, wobei R4 eine Alkyl- oder Arylgruppe darstellt. Die Verbindungen sind – trotz ihres Namens – keine Ether, da keine echte Sauerstoffbrücke zwischen zwei Kohlenstoffatomen vorhanden ist.
Häufig benutzte Silylether sind:
- Trimethylsilyl-Derivate (TMS)
- tert-Butyldiphenylsilyl-Derivate (TBDPS)
- tert-Butyldimethylsilyl-Derivate (TBS/TBDMS)
- Triisopropylsilyl-Derivate (TIPS)
Silylether werden als Schutzgruppe bei organischen Synthesen eingesetzt, welche verhindern, dass im Laufe einer mehrstufigen Synthese vorhandene funktionelle Gruppen mit eingesetzten Reagenzien reagieren. Das besondere an Schutzgruppen ist die Möglichkeit, sie reversibel ohne großen Aufwand hinzuzufügen und wieder abzuspalten.
Bildung
Es sind einige Methoden zur Bildung von Silylethern bekannt, wobei zwei besonders verbreitet sind:
- Die Reaktion des Alkohols mit einem Silylchlorid und einem Amin bei Raumtemperatur
- Die Reaktion des Alkohols mit einem Silyltriflat und einer Aminbase bei niedriger Temperatur
Ein Beispiel ist die Bildung von Silylethern mit Hilfe von Chlortrimethylsilan.
Silylenolether können analog durch Reaktion von Silylchlorid mit der Carbonylfunktion von Aldehyden und Ketonen in Gegenwart einer Aminbase erhalten werden.[1]
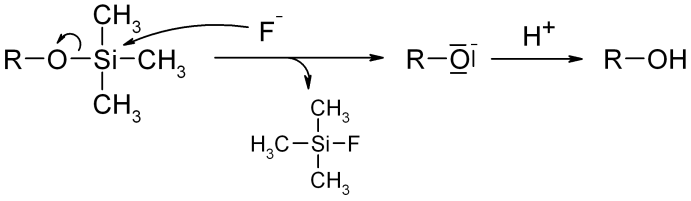
Die Abspaltung kann mit Hilfe von Fluoridionen (z. B. Hexafluorokieselsäure oder Tetrabutylammoniumfluorid in einem polaren aprotischen Lösungsmittel wie THF) erfolgen.
Weblinks
Einzelnachweise
- ↑ House HO, Czuba LJ, Gall M, Olmstead HD (1969): "Chemistry of carbanions. XVIII. Preparation of trimethylsilyl enol ethers", J. Org. Chem., S. 2324, doi:10.1021/jo01260a018.