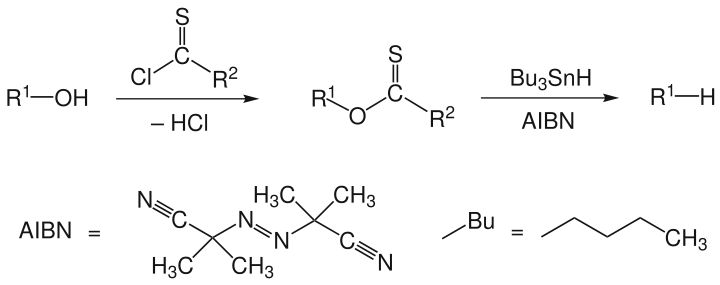
Barton-McCombie-Desoxygenierung
Die Barton-McCombie-Desoxygenierung ist eine Namensreaktion der Organischen Chemie. Sie ist nach den britischen Chemikern Derek Harold Richard Barton und Stuart W. McCombie benannt. Die Reaktion beschreibt eine zweistufige Umsetzung, bei der formal die funktionelle Hydroxygruppe einer Verbindung durch ein Wasserstoffatom substituiert wird. Im ersten Reaktionsschritt erfolgt die Umsetzung des Alkohols zum Thioester, im zweiten Reaktionsschritt die radikalische Desoxygenierung mit Tributylstannan und einem Radikalstarter wie AIBN.[1][2] Im folgenden Schema sind nicht alle Abgangsgruppen aufgeführt.
R1 ist ein Alkylrest, R2 kann H−, CH3−, CH3S−, CH3O−, Ph−, PhO− oder ein Imidazolyl−Rest sein.
Schwefel-Zinn-Bindungen sind sehr stabil. Die Ausbildung einer solchen Bindung ist die treibende Kraft für die gesamte Reaktion.
Mechanismus
Der Reaktionsmechanismus besteht aus einer katalytischen Initiation eines Radikals und der daran anschließenden Propagationsschritten (Kettenreaktion).[3] Der Alkohol (1) wird zunächst in ein reaktiveres Thiocarboxy-Derivat umgewandelt, wie z. B. ein Thionsäureester oder ein Xanthogenat (2). Dann wird ein Tributylstannyl-Radikal (4) durch Umsetzung von Tributylstannan (3) mit Azobis(isobutyronitril) (AIBN) (8) erzeugt. Das Tributylstannyl-Radikal trennt die Xanthogenat-Gruppe von (2) ab, bildet so ein Tributylzinn-Xanthogenat (7) und hinterlässt ein Alkyl-Radikal (5). Das Alkylradikal wiederum abstrahiert ein Wasserstoffatom von einem neuen Tributylstannan-Molekül (3), liefert so das gewünschte desoxygenierte Produkt (6) und erzeugt eine neue Radikalspezies von (4), welches wiederum in die Folgereaktion eintreten kann.
Variationen
Alternative Wasserstoffquellen
Der wesentliche Nachteil dieser Reaktion ist die Verwendung von Tributylstannan. Diese ist sehr toxisch, teuer und schwierig aus dem Reaktionsgemisch zu trennen. Eine Alternative ist die Verwendung von Bis(tributylzinn)oxid (TBTO) als Radikalquelle und Polymethylhydrosiloxan (PMHS) als Wasserstoffquelle.[4] Bei Verwendung von O-Phenyl-chlorthioformiat als Ausgangsmaterial, wird am Ende Carbonylsulfid erzeugt.
Atomökonomie
Die Barton-McCombie-Desoxygenierung liefert zwar das gewünschte Produkt, doch muss auch berücksichtigt werden, dass bei dieser Reaktion erhebliche stöchiometrische Mengen an Abfällen entstehen. Somit ist die Reaktion zwar effektiv, hat aber eine schlechte Atomökonomie. So müssen die Reste des Radikalstarters (hier:Isobutyronitril), sowie das Thioprodukt entsorgt werden. Dies macht die Barton-Desoxygenierung als industrielles Verfahren unwirtschaftlich, sie kann jedoch zur Synthese im Labor verwendet werden.
Die Barton-McCombie-Desoxygenierung ist nicht mit der Barton-Reaktion oder der eng verwandten Barton-Decarboxylierung zu verwechseln.
Weblinks
- Barton-McCombie-Desoxygenierung im Organic Chemistry Portal
- Barton-McCombie-Desoxygenierung im Portal Organische-Chemie.ch
- Artikel zu Alkylboranen
Einzelnachweise
- ↑ Barton, D. H. R.; McCombie, S. W.: A new method for the deoxygenation of secondary alcohols. In: J. Chem. Soc., Perkin Trans. 1. 16, 1975, S. 1574–1585. doi:10.1039/P19750001574.
- ↑ Crich, D.; Quintero, L.: Radical chemistry associated with the thiocarbonyl group. In: Chem. Rev.. 89, 1989, S. 1413–1432. doi:10.1021/cr00097a001.
- ↑ Forbes, J. E.; Zard, S. Z. Tetrahedron Lett. 1989, 30, 4367.
- ↑ Jordi Tormo, Gregory C. Fu: Tributylstannane (Bu3SnH)-Catalyzed Barton−McCombie Deoxygenation of Alcohols: 3-Deoxy-1,2:5,6-bis-O-(1-methylethylidene)-α-D-ribo-hexofuranose In: Organic Syntheses. 78, 2002, S. 239, doi:10.15227/orgsyn.078.0239 (PDF).