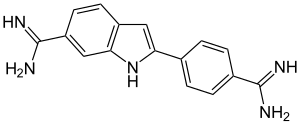
4′,6-Diamidin-2-phenylindol
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | 4′,6-Diamidin-2-phenylindol | ||||||
| Andere Namen |
| ||||||
| Summenformel | C16H15N5 | ||||||
| Kurzbeschreibung |
gelber, geruchloser Feststoff (Dihydrochlorid)[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 277,32 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
4′,6-Diamidin-2-phenylindol, kurz DAPI, ist ein Fluoreszenzfarbstoff, der in der Fluoreszenzmikroskopie zur Markierung von DNA eingesetzt wird.
Eigenschaften
4′,6-Diamidin-2-phenylindol kommt üblicherweise als Dihydrochlorid[2] bzw. dessen Hydrat in den Handel.
DAPI als Fluoreszenzfarbstoff
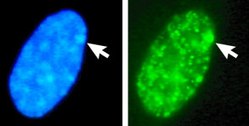
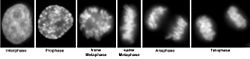
Die Verbindung lagert sich bevorzugt an AT-reiche Regionen in der kleinen Furche doppelsträngiger DNA an. Bei Anregung mit ultraviolettem Licht fluoresziert DAPI im sichtbaren Bereich mit blauer bis cyaner Farbe. In Verbindung mit doppelsträngiger DNA liegt das Absorptionsmaximum bei einer Wellenlänge von 358 nm, das Emissionsmaximum bei 461 nm.
DAPI kann auch an RNA binden, die in den meisten aktiven Zellen in großen Mengen vorhanden ist. Hierbei interkaliert es in die RNA. Die Fluoreszenz ist jedoch fünfmal schwächer als wenn es an AT-reiche DNA gebunden ist. Das Emissionsmaximum liegt dann bei 500 nm.[3][4] Die Emissionsmaxima von DNA- und RNA-gebundenem DAPI unterscheiden sich damit genügend, um sie mit Hilfe von optischen Filtern und Farbteilern trennen zu können. DAPI wird deshalb eingesetzt, um (nur) DNA darzustellen und beispielsweise Zellkerne anzufärben. Dies ist mit vielen anderen Nucleinsäurefarbstoffen nicht möglich, weil die Emissionsspektren der DNA- und der RNA-gebundenen Farbstoffmoleküle nahezu identisch sind. DAPI wird daher häufig als „DNA-spezifisch“ bezeichnet, obwohl dies strenggenommen nur für die Emission bei 461 nm (blau) gilt.
DAPI emittiert am kurzwelligen (blauen) Ende des Spektrums des sichtbaren Lichtes. Daher können gleichzeitig weitere Fluoreszenzfarbstoffe mit langwelligeren Emissionsmaxima am selben Präparat eingesetzt werden, ohne dass es zu Signalüberschneidungen („bleed through“) kommt. DAPI kann zum Beispiel gleichzeitig mit grün, gelb oder rot fluoreszierenden Markern wie Fluorescein, Alexa 488, GFP, Texas Red und vielen anderen angewendet werden. Aufgrund der einfachen Färbetechnik zählt DAPI auch heute noch zu den wichtigen Fluoreszenzfarbstoffen. Die ultraviolette Strahlung, die für die Anregung notwendig ist, erzeugt Radikale, die auch andere Fluorophore bleichen. DAPI wird deshalb bei manchen Anwendungen als letzter Farbstoff angeregt und sichtbar gemacht, um andere Marker zu schonen. Das Ausbleichen (fading) von DAPI kann durch den Einsatz von Anti-Fading-Mitteln verzögert und die Beobachtungsdauer am Mikroskop verlängert werden.
DAPI ist in der Lage, intakte Zellmembranen zu durchdringen, jedoch nur sehr langsam, im Gegensatz zu dem DNA-Farbstoff Hoechst 33342, der ähnliche spektrale Eigenschaften hat und auch lebende Zellen schnell anfärbt. DAPI wird daher für die Anfärbung lebender Zellen nur selten verwendet. Außerdem ist die energiereiche ultraviolette Strahlung, die für Anregung benötigt wird, schädlich für lebende Zellen. Aufgrund der DNA-bindenden Eigenschaften ist es toxisch und mutagen.
DAPI bindet mit einer Rotverschiebung in höheren Konzentrationen auch an Polyphosphate, RNA, Polyadenylat, manche Inositol-Phosphate, Heparin und amorphes Calciumphosphat.[5]
Literatur
- Wilson, W. D., Tanious, F. A., Barton, H. J., Jones, R. L., Fox, K., Wydra, R. L., und Strekowski, L. (1990). DNA sequence dependent binding modes of 4',6-diamidin-2-phenylindole (DAPI). Biochemistry 29, 8452–8461.
Weblinks
Einzelnachweise
- ↑ a b c d e Datenblatt 4′,6-Diamidin-2-phenylindoldihydrochlorid bei Merck, abgerufen am 25. Dezember 2019.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4′,6-Diamidin-2-phenylindol-Dihydrochlorid: CAS-Nummer: 28718-90-3, EG-Nummer: 249-186-7, ECHA-InfoCard: 100.044.700, PubChem: 160166, Wikidata: Q55972278.
- ↑ Awtar Krishan and Payal D. Dandekar (2005): DAPI Fluorescence in Nuclei Isolated from Tumors. Journal of Histochemistry and Cytochemistry, Volume 53 (8): 1033–1036. doi:10.1369/jhc.4B6563.2005.
- ↑ Tanious, F.A. et al. (1992): DAPI (4′,6-diamidino-2-phenylindole) binds differently to DNA and RNA: minor-groove binding at AT sites and intercalation at AU sites. In: Biochemistry. Bd. 31, Nr. 12, S. 3103–3112, PMID 1372825.
- ↑ S. Omelon, J. Georgiou, W. Habraken: A cautionary (spectral) tail: red-shifted fluorescence by DAPI-DAPI interactions. In: Biochemical Society transactions. Band 44, Nummer 1, Februar 2016, S. 46–49, doi:10.1042/BST20150231, PMID 26862187.
