Herpes-simplex-Viren
| Herpes-simplex-Viren | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

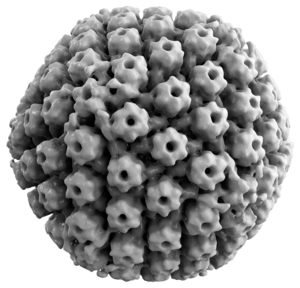
TEM-Aufnahme des Herpes-simplex-Virus 1 | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
Human alphaherpesvirus 1, 2
| ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| HSV-1 und HSV-2 | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
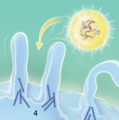
Phagozytose-artiger Eintritt in die Wirtszelle bei HSV
Als Herpes-simplex-Viren (HSV) bezeichnet man zwei eng verwandte humanpathogene (den Menschen infizierende) Virusspezies: das Humane (Alpha-)Herpesvirus 1 (HSV-1) und 2 (wissenschaftlich
bzw.
). Die beiden Spezies wurden ursprünglich als Serotypen derselben Spezies klassifiziert.
Sie gehören beide (neben weiteren nicht-humanpathogenen Spezies) zur Gattung Simplexvirus aus der Unterfamilie Alphaherpesvirinae in der Familie Herpesviridae. Beide werden in erster Linie sexuell übertragen.
Die Herpes-simplex-Viren verursachen sehr verschiedene Erkrankungen des Herpes simplex, darunter die sogenannte Mundfäule bei Kleinkindern. Die häufigsten Symptome einer Infektion dieser Viren sind jedoch Lippenherpes (Herpes labialis) und Genitalherpes (Herpes genitalis). Der Herpes neonatorum des Neugeborenen und auch die Herpes-simplex-Enzephalitis insbesondere bei immunsupprimierten Menschen stellen lebensbedrohliche Komplikationen dar.
Morphologie
Datei:A-Tail-like-Assembly-at-the-Portal-Vertex-in-Intact-Herpes-Simplex-Type-1-Virions-ppat.1002961.s003.ogv Die Herpes-simplex-Viren bestehen aus einem etwa 100 bis 110 nm im Durchmesser großen, ikosaedrischen Kapsid. Dieses ist von etwa 20 Tegumentproteinen umkleidet und von einer äußeren Virushülle umgeben; die vollständigen Virionen sind (abhängig von der Untersuchungsmethodik sehr variabel) etwa 140 bis 180 nm groß. Das Kapsid besteht aus 162 Kapsomeren, davon sind 150 in hexagonaler Symmetrie (Hexone) angeordnet, zwölf in pentagonaler (Pentone). Die Hexone bestehen aus sechs Molekülen des Hauptkapsidproteins VP5 (155 kDa) und sechs Molekülen des Vertex-Proteins VP26; diese zwölf Proteinmoleküle der Hexone sind um eine zentrale Pore herum angeordnet. Je drei Hexone sind in einer Dreieckssymmetrie zusammengefasst, in die zusätzlich die Strukturproteine VP19c und VP23 eingebunden sind. Die Pentone bestehen aus fünf Molekülen des VP5 und befinden sich jeweils an den zwölf Ecken der ikosaedrischen Symmetrie. Zwei weitere Strukturproteine sind in geringer Menge im Kapsid enthalten: VP24, das Eigenschaften einer Protease besitzt und für die Reifung des Kapsids von Bedeutung ist, sowie das in seiner Funktion unklare Genprodukt UL6.
Die das Kapsid bedeckenden Tegumentproteine enthalten wichtige Proteine zur Genregulation der infizierten Zelle und zur Einleitung der viralen Replikation, die noch nicht alle in ihrer Funktion charakterisiert sind. Bekannt sind VP16, das auch als αTIF (alpha-trans-inducing factor) bezeichnet wird, sowie ein Virion-assoziierter Faktor UL41, der die zelluläre Translation unterbinden kann (Host shut-off). Zu den Tegumentproteinen gehören auch die regulatorischen Immediate-early-Proteine (IE) ICP4 und ICP0 und die große Untereinheit der viralen Ribonukleotidreduktase RR1.
Die Virushülle der Herpes-simplex-Viren enthält mindestens zehn verschiedene virale Proteine (überwiegend Glykoproteine), die in eine zelluläre Lipidmembran eingelagert sind. Das Hüllprotein gG-US4 zeigt die meisten Unterschiede zwischen den Spezies HSV-1 und HSV-2 und ist für deren unterschiedliche serologische Eigenschaften verantwortlich. Mindestens vier Hüllproteine (gD-US6, gL-UL1, gH-UL22 und gB-UL26) vermitteln das Eindringen des Virus in die Zelle. Die Sequenz der gB-Proteine ist bei einer großen Zahl von Mitgliedern der Herpesviridae konserviert. Die Hüllproteine US7-gI und US8-gE bilden ein Heterodimer, das die direkte Ausbreitung der Viren zwischen Zellen vermittelt und den Fc-Teil von IgG-Antikörper binden kann.
Genom
Das Genom besteht aus einer 152 kb großen, linearen doppelsträngigen DNA. Die Übereinstimmung zwischen den Nukleotidsequenzen von HSV-1 und HSV-2 beträgt in den meisten Genregionen mehr als 99 %, in der gesamten Sequenz etwa 85 %. Die Abweichungen betreffen überwiegend Gene, die in die Steuerung der viralen Genexpression eingebunden sind oder einige virale Hüllproteine. Während der Virusvermehrung wird die lineare DNA zu einem Ring geschlossen (cccDNA) und kann in dieser Form im Zellkern persistieren. Das Genom codiert mit über 80 Offenen Leserahmen für mehr als 100 Genprodukte.
Histone
Einige Herpesviren können Histone ihres Wirt für ihre eigene Verpackung, Steuerung oder zu ihrem Schutz nutzen. 2022 wurde die Rolle von Histonen im Replikationszyklus einer Reihe von Viren, darunter HSV, umfassend untersucht.[2]
Systematik
- Familie Herpesviridae
- Unterfamilie Alphaherpesvirinae
- Gattung Simplexvirus
- Spezies Herpes-simplex-Virus 1 (HSV-1) oder Humanes Herpesvirus 1 (HHV-1), en. Human alphaherpesvirus 1
- Spezies Herpes-simplex-Virus 2 (HSV-2) oder Humanes Herpesvirus 2 (HHV-2), en. Human alphaherpesvirus 2
- Spezies Herpes-B-Virus en. Macacine alphaherpesvirus 1, veraltet Macacine herpesvirus 1, Cercopithecines Herpesvirus 1 (CeHV-1 oder CHV-1), Herpesvirus simiae
- Spezies Cercopithecine alphaherpesvirus 2 (nicht umbenannt)
...
Quellen
- C. M. Fauquet, M. A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses. London, San Diego, 2005 ISBN 0-12-249951-4
- Allan Granoff, Robert G. Webster (Hrsg.): Encyclopedia of Virology. San Diego 1999, Band 2, S. 677ff ISBN 0-12-227030-4
Weblinks
Einzelnachweise
- ↑ a b c d e ICTV:ICTV Taxonomy history: Human alphaherpesvirus 1, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ Paul B. Talbert, Karim-Jean Armache, Steven Henikoff: Viral histones: pickpocket’s prize or primordial progenitor? In: BMC Epigenetics & Chromatin, Band 15, Nr. 21, 28. Mai 2022; doi:10.1186/s13072-022-00454-7, PMID 35624484, PMC 9145170 (freier Volltext).