Hydroxybenzoesäuren
| Hydroxybenzoesäuren | |||||||||
| Name | 2-Hydroxybenzoesäure | 3-Hydroxybenzoesäure | 4-Hydroxybenzoesäure | ||||||
| Andere Namen | o-Hydroxybenzoesäure Salicylsäure |
m-Hydroxybenzoesäure |
p-Hydroxybenzoesäure | ||||||
| Strukturformel | Struktur von Salicylsäure | Struktur von 3-Hydroxybenzoesäure | 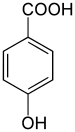
| ||||||
| CAS-Nummer | 69-72-7 | 99-06-9 | 99-96-7 | ||||||
| PubChem | 338 | 7420 | 135 | ||||||
| FL-Nummer | 08.112 | 08.132 | 08.40 | ||||||
| Summenformel | C7H6O3 | ||||||||
| Molare Masse | 138,12 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Kurzbeschreibung | weiße Kristalle | farblose Kristalle | |||||||
| Schmelzpunkt | 158,3 °C[1] | 200 °C[1] | 215 °C[1] | ||||||
| Siedepunkt | 211 °C (20 mmHg)[1] | – | – | ||||||
| pKsCOOH[1] | 2,75 | 3,90 | 4,61 | ||||||
| pKsOH[1] | 12,38 | 9,78 | 9,31 | ||||||
| Löslichkeit in Wasser |
2 g·l−1 (20 °C)[2] | 5 g·l−1 (20 °C)[3] | |||||||
| GHS- Kennzeichnung |
|
|
| ||||||
| H- und P-Sätze | 302‐318‐361d | 302‐315‐319‐335 | 318‐335 | ||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||||
| 280‐301+330+331 305+351+338 |
261‐305+351+338 | 280‐305+351+338‐310 | |||||||
Die Hydroxybenzoesäuren bilden in der Chemie eine Stoffgruppe, die sich sowohl von der Benzoesäure als auch vom Phenol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Carboxy- (–COOH) und Hydroxygruppe (–OH) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere. Sie sind hauptsächlich als Derivate der Benzoesäure anzusehen. Die 2-Hydroxybenzoesäure ist unter ihrem Trivialnamen Salicylsäure bekannt. Die Hydroxybenzoesäuren gehören auch zur Gruppe der Phenolsäuren.
Eigenschaften
Zur Stoffgruppe der Hydroxybenzoesäuren gehören:
- 2-Hydroxybenzoesäure (ortho-Hydroxybenzoesäure), auch bekannt als Salicylsäure
- 3-Hydroxybenzoesäure (meta-Hydroxybenzoesäure)
- 4-Hydroxybenzoesäure (para-Hydroxybenzoesäure), bekannt als PHB, deren Ester die Parabene sind
Sie lösen sich in Diethylether und Aceton. Ähnlich wie viele organische Säuren lösen sie sich in Wasser bei Raumtemperatur kaum, in der Hitze deutlich besser, im Alkalischen unter Abgabe des Protons an der Carboxygruppe und daher Anionenbildung aber gut, und können durch Zugabe einer stärkeren Säure wieder ausgefällt werden.
Weitere Vertreter
Die Hydroxybenzoesäuren sind neben den Hydroxyzimtsäuren in fast allen Gewürzen zu finden. Vielfach liegen sie dort in Form ihrer Ester oder Glykoside vor.
Viele mehrfach mit Hydroxy- und Methoxygruppen substituierte Derivate kommen als Naturstoffe vor:
- Dihydroxybenzoesäuren
- Trihydroxybenzoesäuren, z. B. Gallussäure (3,4,5-Trihydroxybenzoesäure)
- Syringasäure (4-Hydroxy-3,5-dimethoxybenzoesäure)
- Vanillinsäure (4-Hydroxy-3-methoxybenzoesäure)
Nachweis
Ein unspezifischer Nachweis auf Hydroxybenzoesäuren ist die so genannte Vitali-Reaktion.
Einzelnachweise
- ↑ a b c d e f CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Eintrag zu 2-Hydroxybenzoesäure (Salicylsäure) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Mai 2022. (JavaScript erforderlich)
- ↑ a b Eintrag zu 4-Hydroxybenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Oktober 2016. (JavaScript erforderlich)
- ↑ Datenblatt 3-Hydroxybenzoic acid bei Sigma-Aldrich, abgerufen am 16. Oktober 2016 (PDF).


