Strictosidin
aus Wikipedia, der freien Enzyklopädie
(Weitergeleitet von Isovincosid)
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
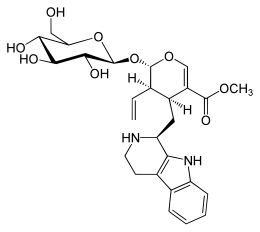
| ||||||||||
| Allgemeines | ||||||||||
| Name | Strictosidin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C27H34N2O9 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 530,55 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Strictosidin ist ein Vincaalkaloid aus Rhazya stricta und dem Madagaskar-Immergrün (Catharanthus roseus) aus der Familie der Hundsgiftgewächse.[3] In der Synthese der Indolalkaloide spielt Strictosidin eine wichtige Rolle: Es ist der vermutete Vorläufer von über 1400 unterschiedlichen Indol-Terpen-Alkaloiden.[4]
Biosynthese
Es entsteht durch Pictet-Spengler-Kondensation von Tryptamin und dem C-7 des Secologanin.[5] Diese Reaktion wird von dem Enzym Strictosidin-Synthase katalysiert.[6]

Synthese von Strictosidin (rechts) aus Tryptamin (links) und Secologanin (mitte): Mannich-artige Kondensation mit anschließender Ringschlussreaktion.
Analytik
Der spezifische Drehwinkel des Hydrochlorids in Methanol beträgt −143° bei 25 °C im Natriumlicht.[7]
Einzelnachweise
- ↑ Renyer Alves Costa, Maria Lucia Belem Pinheiro, Kelson Mota Teixeira de Oliveira, Andersson Barison, Kahlil Schwanka Salomé, Júlio Rodolfo Iank, Noam Gadelha da Silva, Tiara Souza Cabral, Emmanoel Vilaça Costa: Structural, Vibrational, and Electronic Properties of the Glucoalkaloid Strictosidine: A Combined Experimental and Theoretical Study. In: Journal of Chemistry. Band 2016, 2016, ISSN 2090-9063, S. e1752429, doi:10.1155/2016/1752429 (hindawi.com).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Von Strictosidin existieren verschiedene Stereoisomere, von denen das 3-α(S)-Isomer das biologisch aktive ist und in diesem Artikel besprochen wird.
- ↑ R. Hänsel, O. Sticher, E. Steinegger: Pharmakognosie – Phytopharmazie. 6. Auflage. Band 1. Springer, Berlin / Heidelberg 1999, ISBN 978-3-662-09269-9, S. 1029, doi:10.1007/978-3-662-09269-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Rimpler: Biogene Arzneistoffe (2. Auflage). S. 307–308.
- ↑ Bayer: Charakterisierung der Vinorin-Synthase aus „Rauvolfia serpentina“ durch Reinigung, Expression, Mutation und Kristallisation, Dissertation im Fachbereich Chemie und Pharmazie der Johannes-Gutenberg-Universität in Mainz (2003), S. 9.
- ↑ Eintrag zu Strictosidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.