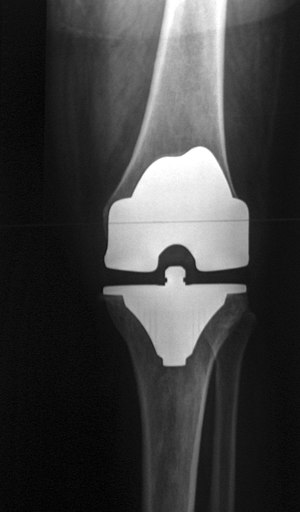
Knieprothese
Eine Knieprothese, Knieendoprothese oder Kniegelenksprothese ist eine implantierte Prothese (Endoprothese), die das Kniegelenk ganz (als TEP) oder teilweise ersetzt. Die Knieprothese wird hauptsächlich bei schwerem Verschleiß des Knies (Kniegelenksarthrose) und nach Verletzungen des Knies als operative Therapie eingesetzt, um die schmerzfreie Bewegungsfähigkeit und ggf. bei Bandinstabilitäten zusätzlich auch die Kniegelenksstabilität wiederherzustellen. Es können Teil- oder Totalendoprothesen (als Halb- oder Ganzgelenke) verwendet werden. Die Knieprothese ist nach der Hüftgelenksprothese die am zweithäufigsten verwendete Gelenksendoprothese mit deutschlandweit jährlich etwa 175.000 Erst-Operationen (Erstimplantationen 2009).[1]
Dieser Artikel beschäftigt sich nicht mit der externen Knieprothese bzw. dem Prothesenknie nach Amputationen oberhalb des Kniegelenks.
Indikationen und Kontraindikationen
Datei:Schematische Darstellung von Knieprothesen-Typen.pdf Der Einsatz einer Knieprothese kann notwendig werden bei:
- degenerativer Arthrose (Beschädigung des Gelenkknorpels)
- rheumatoider Arthritis (Entzündung des Gelenks mit Knorpelschädigung)
- posttraumatischer Arthritis (Arthritis nach Unfall)
- symptomatischer Knieinstabilität (Verletzungen des Bandapparats)
- Knieversteifung (Rekonstruktion der Beweglichkeit des Gelenks)
- Deformationen des Kniegelenks
- Rekonstruktion einer Kniegelenksfunktion nach Resektionen im Rahmen der Tumorchirurgie
Je nach Erkrankung und deren Schweregrad muss der Arzt aus den unterschiedlichen Implantattypen die bestmögliche Lösung und Therapie für den Patienten auswählen. Die richtige Indikationsstellung liegt allein im Verantwortungsbereich des behandelnden Arztes. Die betroffenen Patienten sollten auch in den Entscheidungsprozess einbezogen werden, damit Arzt und Patient sich über die Vorstellungen und Bedürfnisse der Patienten und die Abläufe und zu erwartende OP-Ergebnisse austauschen. So können diese Faktoren bei der Indikationsstellung berücksichtigt werden.
Eine Knieprothese sollte nicht eingesetzt werden, wenn ein rekonstruktiver Eingriff (z. B. Osteotomie) zur Therapie des Gelenkleidens möglich ist, akute oder chronische Infektionen im Gelenk oder in dessen Nähe oder systemische Infektionen vorliegen. Gegenanzeigen sind auch Störungen im Knochen selbst wie beispielsweise Störungen des Stoffwechsels, eine Osteoporose oder Osteomalazie, eine Schädigung der Knochenstruktur, die eine stabile Verankerung des Implantats verhindern oder Knochentumoren im Bereich der Implantatverankerung. Bei knöchernen Missbildungen oder extremen Achsfehlstellungen ist die Knieprothese ebenfalls kaum einsetzbar. Eine mögliche oder nachgewiesene Metallallergie oder -unverträglichkeit stellt ebenfalls eine Kontraindikation dar. Eine zu erwartende Überlastung des Implantats zum Beispiel durch Adipositas (Übergewicht) gilt als Risikokonstellation; ebenso Medikamenten-, Drogen- oder Alkoholsucht.
Einteilung der Knieprothesen
Knieprothesen teilt man nach ihrem Koppelungsgrad ein. Das heißt, je mehr Funktionalität des natürlichen Bandapparats im Kniegelenk beschädigt ist und von der Knieprothese übernommen werden muss, desto höher der Koppelungsgrad. Das Kniegelenk ist ein sogenanntes Roll-Gleit-Gelenk. Während des normalen Gangs rotiert der Unterschenkel um den Oberschenkelknochen und gleitet dabei nach vorn. Die Kniekinematik ist dadurch sehr komplex.
Bei der Bewegung von der Flexion in die Extension (vom gebeugten in das gestreckte Knie) rotiert der Unterschenkel um den Oberschenkel nach vorne. Dabei dreht sich der Fuß und somit der Unterschenkel um den medialen (inneren) Kondylus nach außen. Bei der Bewegung von der Extension in die Flexion rotiert der Unterschenkel um den Oberschenkel nach hinten. Dabei dreht sich der Fuß nach innen und der Unterschenkel gleitet nach vorn. Diese komplexe Kinematik kommt durch die Form der Gelenkflächen, der Menisken und vor allem durch die Anordnung der Bänder und Muskeln zustande.
Das sogenannte Uniknie (unikondyläre (syn. monokondyläre) Schlittenprothese) kommt zu Anwendung, wenn alle Bänder am Kniegelenk voll funktionsfähig sind und nur an einem der beiden Kondylen eine Schädigung des Gelenkknorpels vorliegt. Während die Komponente femoral uniform aus einer Metalllegierung besteht, existieren tibial drei verschiedenen Grundtypen: reine Polyethylenkomponente (sog. all-poly, z. B. Genesis, Journey, Mod I, St. Georg, UC plus), fest fixierte PE-Komponente mit Metallbasis (sog. metal-backed, z. B. Genesis, Journey, Mod II, UC Plus) oder analoge Varianten mit mobiler PE-Komponente (z. B. Oxford, LCS uni). Eine bikondyläre Primärprothese kann zum Einsatz kommen, wenn mindestens zwei der drei Gelenkabschnitte (inneres bzw. äußeres Kompartment sowie Kniescheibe mit Gleitlager) und ggf. auch das vordere Kreuzband beschädigt sind, die anderen Bänder aber ausreichend funktionsfähig sind. Es werden sowohl am Oberschenkelknochen als auch am Schienbein die Gelenkflächen ersetzt. Die Menisken werden entfernt. Es gibt auch einzelne Implantatsysteme, die selbst bei intaktem vorderem Kreuzband eingesetzt werden können.
Bei den primären Totalendoprotehsen erfolgt eine Einteilung der Prothesen in der Regel danach, ob die Kreuzbänder erhalten werden, dann wird eine CR-Prothese ("cruciate retaining" = Kreuzband-erhaltende Prothese) eingesetzt. Sind die Kreuzbänder nicht erhalten, oder werden sie im Rahmen der Operation entfernt, wird eine Prothese verwendet, die die Funktion der Kreuzbänder teilweise übernimmt. Dies ist eine PS-Prothese ("posterior stabilised = posterior stabilisierte Prothese). Diese führt das Schienbein bei zunehmender Beugung nach vorne bzw. den Oberschenkelknochen nach hinten.
Für den Drehgleitmechanismus gibt es dabei drei Verfahren, die jedes ein anderes Design der Tibiakomponente haben, während Femur- und Patellakomponente gleich bleiben:
- Die Tibiakomponente besteht ausschließlich aus Polyethylen, und dieses wird mittels Knochenzement direkt auf den präparierten Schienbeinknochen gesetzt (all-polyethylene).
- Eine Polyethylenkomponente wird fest fixiert auf eine Metallkomponente aufgesetzt, die wiederum im Schienbein entweder mit oder ohne Zement verankert wird (modular metal backed oder fixed bearing).
- Eine Polyethylenkomponente wird so auf eine Metallkomponente aufgesetzt, dass sie sich in einem vorgegebenen Rahmen gegen die Metallkomponente bewegen kann, was vorwiegend ein Gleitmechanismus bei Kniebeugung ist (rotating platform, oder mobile bearing). Die Metallkomponente wird wiederum zementiert oder unzementiert im präparierten Schienbeinknochen fixiert.
Eine prospektive randomisierte Studie hat diese drei Komponenten eines Herstellers bei immer gleichen Femur- und Patellakomponenten miteinander verglichen, die Operateure waren sehr erfahren und gleichermaßen mit allen drei Tibiakomponenten vertraut, und konnte bei jeweils 75–76 Patienten pro Gruppe nach zwei und fünf Jahren keinerlei signifikante noch klinische Unterschiede nachweisen, was Beweglichkeit, Kraft, Funktion und Zufriedenheit betrafen. Bei insgesamt nur vier Revisionen erlaubt diese Studie noch keine Aussagen über die Langzeit-Standfestigkeit.[2]
Sind sowohl die Kreuzbänder als auch die Seitenbänder beschädigt, die Gelenkkapsel und der Muskelapparat aber noch gut intakt, kann eine sogenannte achsgeführte Rotationsprothese (Rotating-Hinge) eingesetzt werden. Hier übernimmt das Implantat die Stabilisierung des Gelenks sowohl nach vorne und hinten als auch nach links und rechts. Es lässt aber eine Rotation der Tibia gegen das Femur zu, das heißt, der Fuß kann noch nach außen gedreht werden.
Als letzte Möglichkeit gilt das achsgeführte Knie. Sind auch die Kapsel und der Muskelapparat beschädigt, was oft mit großen Knochendefekten einhergeht, muss auch die Rotation der Tibia gegen das Femur, sprich das Drehen des Fußes, eingeschränkt und das Kniegelenk so weiter stabilisiert werden. Hier kann nun nur noch die Tibia gegen das Femur nach vorne und hinten bewegt werden.
Historisches
Die erste Implantation von Scharniergelenken erfolgte 1890 durch den Berliner Chirurgen Themistocles Gluck: Bei drei Patienten mit Gelenkszerstörung im Rahmen einer Tuberkulose wurde ein einfaches Scharnier aus Elfenbein implantiert, die Fixierung erfolgte mit vernickelten Schrauben und Kolophonium, einem Harz. Die Versuche schlugen durch Infektionen fehl. Ein weiterer Versuch erfolgte durch Judet 1947 mit einer Acrylharzprothese. Die erste Scharnierendoprothese, die auch in größeren Fallzahlen erfolgreich implantiert wurde, war das Modell von Walldius ab 1951, das in der Folge noch mehrfach modifiziert wurde. Weitere bekannte frühe Formen der Scharnierendoprothese waren die Modelle von Shiers[3] ab 1953, Engelbrecht ab 1970, Groupe Guepar ab 1970, Sheehan ab 1971, Blauth ab 1972 und Gschwend-Schleier-Bähler (GSB) ab 1972.
Ein isolierter Ersatz der Femurkondylen erfolgte in Einzelfällen durch Entwicklungen von Campbell ab 1940, Smith-Petersen ab 1942 und Rocher ab 1952. Größere Fallzahlen sind bekannt für die Modelle von Aufranc-Jones-Kermond ab 1953 sowie Platt-Pepler ab 1955.
Der isolierte Ersatz tibial erfolgte in ersten Modellen von Marquard ab 1951, McKeever ab 1952 und McIntosh ab 1956.
Die ersten Gleitflächenersatzprothesen, also der Ersatz der Gleitflächen femoral und tibial medial und/oder lateral ohne mechanische Kopplung stammten von Gunston ab 1968 (femoral Stahl, tibial Polyethylen) und von Engelbrecht (Modell St. Georg) ab 1969 (femoral Stahl Kobalt Chrom Molybdän, tibial Polyethylen), Freeman/Swanson ab 1970 und Marmor ab 1975.
Verwendete Werkstoffe
Der am häufigsten verwendete Werkstoff ist die Cobalt-Chrom-Gusslegierung CoCr29Mo nach ISO 5832-4 für die Femur- und Tibia-Implantatkomponenten. Für Augmentationskeile und Platten wird häufig eine Cobalt-Chrom-Legierung nach ISO 5832-12 verwendet. Es kommen auch Titanlegierungen oder Oberflächenbeschichtungen aus Zirconiumnitrid, Titannitrid oder Titanniobnitrid zum Einsatz, die vor allem für Patienten mit Metallallergie wie z. B. Nickelallergie verwendet werden. Bei Titanlegierungen wird das Titan an den artikulierenden Flächen, aufgrund der geringen Abriebresistenz, mit einem speziellen Oberflächenhärtungsverfahren mit Stickstoffionen behandelt. Die Oberflächenbeschichtungen werden im PVD-Verfahren aufgedampft. Die Inlays (Meniskenersatz) sind in der Regel aus UHMWPE (ultra hochmolekulares Polyethylen) nach ISO 5834-2 hergestellt.
Verankerung und Belastung des Implantats
Implantate werden meist mit Knochenzement am Knochen verankert. Wahlweise kann auch eine Verankerung ohne Knochenzement gewählt werden. Dann sind die Implantatkomponenten meist mit einer Beschichtung versehen, welche eine besonders poröse und damit große Oberfläche hat, die ein An-/Einwachsen des Knochen begünstigen und so eine sichere Verankerung gewährleistet. Bis der Knochen in diese Schicht eingewachsen ist, hält das Implantat durch den sogenannten Presssitz ("press-fit"). Das heißt, das Implantatlager im Knochen wird so präpariert, dass die Prothese in dem Knochen festklemmt.
Um den Körper zu stabilisieren, wirken im Kniegelenk erhebliche Muskelkräfte, die zusätzlich zum Körpergewicht das Gelenk komprimieren und damit belasten. Diese Kräfte können mit mathematischen Modellen annähernd berechnet oder mit instrumentierten Messprothesen direkt gemessen werden. Zum Beispiel haben Forscher des Julius-Wolff-Instituts der Berliner Charité eine instrumentierte Knieprothese zur Belastungsmessung entwickelt und bei mehreren Patienten eingesetzt. Die Messdaten werden dabei drahtlos an einen Computer übertragen. Die Ergebnisse zeigen, dass schon beim Gehen eine resultierende Kraft vom ca. 2,5-fachen des Körpergewichts auf das Gelenk wirkt. Beim Treppabgehen steigt die resultierende Kraft sogar bis zum 3,5-fachen des Körpergewichts.
Aktuelle Entwicklungen
Nach dem Jahresbericht 2019[4] des deutschen Endoprothesenregisters (EPRD) werden in der Regel zementierte Knieprothesen eingesetzt, nur 2 % sind zementfrei, und 5 % Hybrid, d. h. eine Komponente ist zementiert, die andere zementfrei. Der Ersatz der Kniescheiben-Rückseite erfolgt seit Jahren immer seltener, aktuell nur noch in 15 % der Fälle. Hingegen steigt die Verwendung von "posterior stabilisierten" (PS) Knietotalendoprothesen seit Jahren an und erreicht aktuell 23 %. Bewegliche Polyethylen-Komponenten ("mobile bearing") werden ebenfalls zunehmend seltener implantiert, aktuell nur noch in 16 %. Der Anteil unikondylärer Knieprothesen nimmt über die Jahre zu und liegt aktuell bei 12 %. Besonders für unikondyläre Prothesen zeigt sich ein deutlich besseres Operationsergebnis in Kliniken, in denen dieser Eingriff sehr häufig durchgeführt wird, im Vergleich zu Kliniken, die den Eingriff selten durchführen.[5]
Ergebnisse
In einer Studie des schwedischen Endoprothesenregisters von 2012 ergaben sich für Primärimplantationen des kompletten Kniegelenkes (Totalendoprothese mit und ohne Kniescheibenersatz) Zehnjahres-Überlebensraten von ca. 95 % und für unikondyläre Schlittenprothesen von ca. 85–90 %.[6] Dies bedeutet, dass statistisch nach zehn Jahren ca. 5 % bzw. 10–15 % der Kniegelenke entfernt bzw. gewechselt wurden, alle anderen Endoprothesen dagegen nicht. Hieraus lässt sich aber weder das individuelle Wechselrisiko noch das individuelle klinische und subjektive Einzelergebnis ableiten. Zielgröße war allein der durchgeführte Ausbau oder Wechsel. Gründe für einen Wechsel einer unikondylären Schlittenprothese kann z. B. die Arthrose des bisher nicht versorgten Kompartments bei intakter Prothese selber sein, umgekehrt kann eine nicht gewechselte Endoprothese prinzipiell zur Wechseloperation anstehen, welche jedoch aus anderen Gründen nicht durchgeführt wurde.
Individuelle Kniegelenksprothesen
Bei jüngeren Patienten kommen gelegentlich individuell für den Patienten und dessen Geometrie gefertigte Prothesen zum Einsatz. Dabei müssen die hierfür notwendigen Maße zuvor mittels Computertomographie ermittelt werden. Auf Basis der CT-Daten wird am Computer ein virtuelles 3D-Modell vom Knie des Patienten erstellt, woraus eine Schablone gefertigt wird, eine sogenannte Negativ-Form, mit deren Hilfe das Implantat gefertigt wird. Auch das notwendige OP-Werkzeug wird individuell auf die Anatomie des Patienten abgestimmt und im 3D-Druckverfahren gefertigt. Das OP-Werkzeug dient der präzisen Durchführung der Knochenschnitte und der Positionierung des Ersatz-Gelenks. Eine korrekte Positionierung und Ausrichtung soll zu möglichst geringem Knochenverbrauch und einer langen Lebensdauer der Prothese beitragen. Diese Verfahren kann sowohl für Teilprothesen als auch als Total-Knieendoprothesen genutzt werden. Neben den höheren Kosten für die individuelle Anfertigung der Prothese resultieren aus diesem Verfahren auch eine höhere Strahlenbelastung durch die Computertomographie und eine längere OP-Zeit. Dass die Haltbarkeit der Prothesen verlängert werden kann, ist bisher im Langzeitverlauf nicht belegt.
Risiken und Komplikationen
Es können prinzipiell Frühkomplikationen in den ersten drei bis sechs Monaten und Spätfolgen unterschieden werden sowie prothesenspezifische und allgemeine Operationskomplikationen.
Zu den prothesenspezifischen Risiken gehören insbesondere die Möglichkeit einer Prothesenlockerung, die in der Regel einen Austausch der gelockerten oder aller Prothesenteile erforderlich macht, sowie die Protheseninfektion durch Bakterien (und sehr selten durch Mykose).
Eine typische Frühkomplikation ist die tiefe Beinvenenthrombose, die trotz Vorbeugung durch frühzeitige Mobilisation und prophylaktischer Antikoagulation am operierten und ebenso am nichtoperierten Bein auftreten kann und auch Auslöser einer Lungenembolie sein kann.
Allgemeine operative Risiken sind ein oberflächlicher Wundinfekt, eine Wundheilungsstörung, eine Serombildung, ein persistierender Kniegelenkserguss sowie Verletzungen naheliegender Nerven.
In einer dänischen Übersicht über alle zwischen 1997 und 2011 durchgeführten Erstimplantationen einer kompletten Knieprothese aufgrund eines Verschleißes wurden die Risiken in den ersten drei Monaten berechnet.[7] Die 32.754 Prothesen wurden in 63 % bei Frauen, in 36 % bei Männern implantiert; 15 % der Patienten waren über 80 Jahre, in 77 % erfolgte eine Regionalanästhesie und in 20 % eine Allgemeinanästhesie. 78 % der Prothesen wurden zementiert, 8 % unzementiert, 14 % waren teilzementierte Hybridprothesen. Bei 63 % der Operationen lag die Dauer bei 61–120 Minuten. Alle Patienten erhielten eine prophylaktische Antikoagulation. Die 90-Tage-Risiken betrugen:
- 1,5 % für eine tiefe Beinvenenthrombose (und bereits 1,1 % im ersten Monat), als Risikofaktoren wurden eine erhöhte Komorbidität, eine Operationszeit über 120 Minuten und eine Hybrid-Verankerung festgestellt. Somit war das Risiko einer Thrombose trotz Antikoagulation fast um Faktor 3 höher als das einer Blutung.
- 0,4 % für einen Herzinfarkt (0,3 % im ersten Monat)
- 0,5 % für einen ischämischen Schlaganfall (0,3 % im ersten Monat)
- 0,5 % für eine starke Blutung, vor allem im Magendarmtrakt (0,3 %) und selten als Hirnblutung (0,04 %)
- 0,7 % insgesamt für einen Tod (0,3 % im ersten Monat)
Bei schwerwiegenden Komplikationen kann am Ende eine Oberschenkel-Amputation unvermeidlich sein. Dieses Risiko wurde anhand Daten der dänischen nationalen Register für alle Knieprothesen (92.785) ausgewertet, die zwischen 1997 und 2013 implantiert wurden, und liegt bei 0,32 % (115 Fälle), nach durchschnittlich 2,9 Revisionseingriffen nach der ersten Knieprothese. Hauptursachen waren unbeherrschbare periprothetische Infektionen (83 % bei Mehrfachnennungen), Weichteildefekte (23 %), schwere Knochenverluste (18 %), unbehebbarer Verlust des Kniestreckapparates und unbeherrschbare Schmerzen (je 11 %), periprothetische Knochenbrüche (9 %) und Gefäßkomplikationen (8 %). Männer waren häufiger betroffen, ebenso Patienten, die die Knieprothese aufgrund einer posttraumatischen Arthrose oder einer rheumatoiden Arthritis erhalten hatten.[8]
Anhaltende Schmerzen nach dem Eingriff
Die Internationale Vereinigung für Schmerzforschung definiert anhaltende Schmerzen nach chirurgischem Eingriff als mindestens drei Monate lang andauernd.[9][10]
Studien haben gezeigt, dass bis zu 44 % aller Patienten mit eingebauter Knietotalendoprothese von solchen Schmerzen betroffen sind.[11][12][13][14]
Bedeutende Hersteller und Marken
- Aesculap-Werke: Columbus, Vega, Univation, e.motion
- Amplitude Surgical: Anatomic, Score, Score AS, Uni Score
- Baumer S/A: AKS (Anatomic Knee System)
- ConforMIS: iTotal, iUni, iDuo, iPoly
- Corin Group: Unity, Uniglide, HLS KneeTec
- DJO Global: EMPOWR
- Exactech: Truliant, Optetrak Logic
- Japan Medical Dynamic Marketing (JMDM) mit Ortho Development Corporation: Balanced Knee, BKS TriMax
- Johnson & Johnson medical (DepuySynthes): LCS Complete, P.F.C. Sigma, Attune
- Mathys AG: Balansys
- Medacta International: GMK Sphere, GMK Primary
- MicroPort Scientific Corporation (Übernahme der Sparte 2014 von Wright Medical): Evolution, Advance
- Waldemar Link: Gemini
- Stryker Corporation: Duracon, Triathlon, Scorpio
- Smith & Nephew: Journey, Legion, Genesis II
- United Orthopedic Corporation (UOC): U2
- Zimmer Biomet Holdings: Vanguard, VanguardXP, NexGen, LPS flex, Persona
Quellen
- Ch. Lüring, H. Bäthis u. a.: Die navigationsgestützte Knieendoprothetik: Eine Standortbestimmung unter evidenzbasierten Kriterien. In: Dtsch Arztebl. Band 102, Nr. 34-35, 2005. (pdf)
- J. Jerosch, S. Fuchs, J. Heisel: Knieendoprothetik – eine Standortbestimmung. In: Dtsch Arztebl. Band 94, Nr. 8, 1997. (pdf)
- H. Federau: Die Entwicklung der Knieendoprothese. Dissertation. Medizinische Fakultät München, 1979.
- S. Grüner: Kurz- und mittelfristige Ergebnisse der alloarthroplastischen Versorgung des Kniegelenkes mit uni- und bikondylären Schlittenprothesen. Dissertation. Medizinische Fakultät Universität Köln, 1992.
Weblinks
- Diashow zur Implantation einer Knieprothese (Memento vom 19. April 2015 im Internet Archive)
- Instrumentierte Knieprothese zur in vivo Messung der Kräfte und Momente Julius Wolff Institut, Charité – Universitätsmedizin Berlin
- "OrthoLoad" Internet-Datenbank mit Ergebnissen von Belastungsmessungen mit Knieprothesen (englisch)
- Endoprothesenregister: Höchsten Anforderungen genügen
Einzelnachweise
- ↑ Barmer GEK: Barmer GEK Report Krankenhaus 2010 - Schwerpunktthema: Trends in der Endoprothetik des Hüft- und Kniegelenks (PDF; 1,9 MB). 2011, S. 9.
- ↑ M. M. Kalisvaart, M. W. Pagnano, R. T. Trousdale, M. J. Stuart, A. D. Hanssen: Randomized clinical trial of rotating-platform and fixed-bearing total knee arthroplasty: no clinically detecatable differences at five years. In: The Journal of Bone and Joint Surgery. American volume. Band 94, Nummer 6, 21. März 2012, S. 481–489, ISSN 0021-9355. doi:10.2106/JBJS.K.00315.
- ↑ bjj.boneandjoint.org.uk
- ↑ Endoprothesenregister Deutschland (EPRD): Jahresbericht 2019, daebl.de
- ↑ Vera Zylka-Menhorn: Endoprothetik: Aktive Rolle des Patienten gefragt. In: Deutsches Ärzteblatt. Jahrgang 117, Heft 9, 28. Februar 2020, S. A-438/B-382/C-369, (aerzteblatt.de)
- ↑ knee.nko.se (Memento vom 26. November 2013 im Internet Archive)
- ↑ A. B. Pedersen, F. Mehnert, H. T. Sorensen, C. Emmeluth, S. Overgaard, S. P. Johnson: The risk of venous thromboembolism, myocardial infarction, stroke, major bleeding and death in patients undergoing total hip and knee replacement. In: The Bone & Joint Journal. Band 96-B, Ausgabe 4, April 2014, S. 479–485. doi:10.1302/0301-620X.96B4.33209
- ↑ Tinne B. Gottfriedson, Henrik M. Schrøder, Anders Odgaard: Transfermoral amputation after failure of knee arthroplasty. In: The Journal of Bone & Joint Surgery. Band 98-A, Ausgabe 23, 7. Dezember 2016, S. 1962–1969. doi:10.2106/JBJS.15.01362
- ↑ V. Wylde, S. Hewlett, I. D. Learmonth, P. Dieppe: Persistent pain after joint replacement: prevalence, sensory qualities, and postoperative determinants. In: Pain. 2011.
- ↑ IASP. Classification of chronic pain. In: Pain. 1986, S. S1–S226.
- ↑ P. N. Baker, J. H. van der Meulen u. a.: The role of pain and function in determining patient satisfaction after total knee replacement: data from the National Joint Registry for England and Wales. In: J Bone Joint Surg Br. Band 89B, 2007, S. 893–900. PMID 17673581. doi:10.1302/0301-620X.89B7.19091
- ↑ V. A. Brander, S. D. Stulberg u. a.: Predicting total knee replacement pain: a prospective, observational study. In: Clin Orthop Relat Res. Band 416, 2003, S. 27–36.
- ↑ P. A. Puolakka, M. G. Rorarius u. a.: Persistent pain following knee arthroplasty. In: Eur J Anaesthesiol. Band 27, 2010, S. 455–460. PMID 14646737. doi:10.1097/01.blo.0000092983.12414.e9
- ↑ V. Wylde, A. W. Blom u. a.: Patient-reported outcomes after total hip and knee arthroplasty: comparison of midterm results. In: J Arthroplasty. Band 24, 2009, S. 210–216. PMID 18534427. doi:10.1016/j.arth.2007.12.001