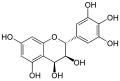
Leukocyanidin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| (2R,3S,4S)-Leukocyanidin | ||||||||||
| Allgemeines | ||||||||||
| Name | Leukocyanidin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C15H14O7 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Wirkstoffklasse |
Kapillartherapeutikum | |||||||||
| Wirkmechanismus | ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 306,27 g·mol−1 | |||||||||
| Schmelzpunkt |
> 335 °C (Hydratform)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Leukocyanidin ist ein sekundärer Pflanzeninhaltsstoff aus der Gruppe der Leukoanthocyanidine.
Isomere
Die Verbindung hat drei chirale Zentren, beschrieben sind die (2R,3S,4S)-Form [(+)-2,3-trans-3,4-cis-Leukocyanidin, kurz cis-Leukocyanidin] und (2R,3S,4R)-Form [(+)-2,3-trans-3,4-trans-Leukocyanidin].
Leucocianidol[4] ist der internationale Freiname für Flavan-3,3′,4,4′,5,7-hexol.[5]
Vorkommen
Leukocyanidin wurde unter anderem im „Kino“ (Exsudat der Rinde) des Malabar-Lackbaums[6] und Blütenblättern von Baumwollpflanzen[7] gefunden.
cis-Leukocyanidin ist im Pflanzenstoffwechsel die biologische Vorstufe des Anthocyanidins Cyanidin.
Eigenschaften
Als Vertreter aus der Gruppe der Leukoanthocyanidine ist Leukocyanidin farblos, chemisch instabil und bildet leicht polymere Verbindungen (Catechingerbstoffe).[8] Synthese und Eigenschaften sind in der Literatur beschrieben.[9][10][11]
Verwandte Verbindungen
Strukturell eng verwandt sind Leukodelphinidin und Leukopelargonidin[12], die sich durch den Grad der Hydroxylierung am Phenylring unterscheiden.
Einzelnachweise
- ↑ Amtliche Fassung des ATC-Index mit DDD-Angaben für Deutschland im Jahre 2020 (PDF), abgerufen am 15. Oktober 2020.
- ↑ J. Elks, C.R. Ganellin (Hrsg.): The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer, 1990. S. 628. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Leucocianidol: CAS-Nummer: 480-17-1, PubChem: 71629, ChemSpider: 64694, Wikidata: Q104876893.
- ↑ WHO: Recommended International Nonproprietary Names, List 40, WHO Drug information, 1998 (PDF)
- ↑ A.K.Ganguly, T.R.SeshadriA study of leucoanthocyanidins of plants─II: (+)Leucocyanidin from the gum of Butea frondosa. Tetrahedron. Band 6 (1959), S. 21–23. doi:10.1016/0040-4020(59)80031-4.
- ↑ S.G. Stephens: Spectrophotometric evidence for the presence of a leucoprecursor of both anthoxanthin and anthocyanpigments in Asiatic cotton flowers. Archives of Biochemistry and Biophysics, Band 18 (1948), S. 449-449. PMID 18878747.
- ↑ T. Dingermann, K. Hiller, G. Schneider, I. Zündorf: Schneider Arzneidrogen. 5. Auflage. Elsevier 2004, ISBN 3-8274-1481-4, S. 306 f.
- ↑ J. Zhang, J. Tolchard, K. Bathany, B. Langlois d’Estaintot, J. Chaudiere: Production of 3,4-cis- and 3,4-trans-Leucocyanidin and Their Distinct MS/MS Fragmentation Patterns. Journal of Agricultural and Food Chemistry, Band 66 (2018), S. 51–358, doi:10.1021/acs.jafc.7b04380.
- ↑ L.J. Porter, L.Y. Foo: Synthesis and properties of (2R,3S,4R)-(+)-3,4,5,7,3′,4′-hexahydroxyflavan. Phytochemistry, Band 21 (1980), S. 2947–2952, doi:10.1016/0031-9422(80)85075-8.
- ↑ W. Heller, L. Britsch, G. Forkmann, H. Grisebach: Leucoanthocyanidins as intermediates in anthocyanidin biosynthesis in flowers of Matthiola incana R. Br. Planta, Band 163 (1985), S. 191–196. doi:10.1007/BF00393505.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Leukopelargonidin: CAS-Nummer: 520-17-2, PubChem: 440073, ChemSpider: 389080, Wikidata: Q3237095.