Lithiumborhydrid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Li+ _ H _ B3+ | |||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | ||||||||||||
| Gitterparameter |
a = 7,17858(4) Å, b = 4,43686(2) Å, c = 6,80321(4) Å[1] | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Lithiumborhydrid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | LiBH4 | ||||||||||||
| Kurzbeschreibung |
hygroskopischer hellgrauer Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 21,78 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Dichte |
0,6660 g·cm−3[2] | ||||||||||||
| Schmelzpunkt |
280 °C[2] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Lithiumborhydrid ist eine chemische Verbindung aus der Gruppe der Lithiumverbindungen und Borane.
Gewinnung und Darstellung
Lithiumborhydrid kann durch eine Metathese-Reaktion von Natriumborhydrid und Lithiumbromid erzeugt werden.[4]
Die direkte Bildung aus metallischem Lithium, Bor und Wasserstoff ist im Prinzip möglich, erfordert aber extreme Bedingungen (150 at Wasserstoffdruck, 650 °C).[5]
Auch die Herstellung aus (intermediärem) Diboran (zum Beispiel aus Lithiumhydrid mit Bortrifluorid in Diethylether) ist möglich.[5][3]
Eigenschaften
Lithiumborhydrid ist ein brennbarer, hygroskopischer, weißer bis grauer Feststoff. Er zersetzt sich bei Kontakt mit Wasser oder feuchter Luft und bildet dabei Wasserstoff.[2]
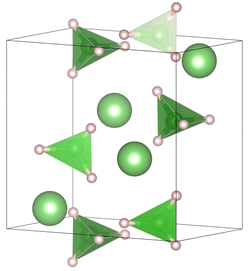
Die Verbindung kristallisiert bei Raumtemperatur in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterkonstanten a = 7,17858(4) Å, b = 4,43686(2) Å, c = 6,80321(4) Å in einer orthorhombischen verzerrten Wurtzit-Struktur. Bei höheren Temperaturen liegt eine hexagonale Kristallstruktur in der Raumgruppe P63mc (Raumgruppen-Nr. 186) mit den Gitterkonstanten a = 4,27631(5) Å, c = 6,94844(8) Å vor.[1]
Verwendung
Lithiumborhydrid wird als Reduktionsmittel für Aldehyde, Ketone, Lactone, Epoxide und Ester in der organischen Chemie verwendet.[2]
Einzelnachweise
- ↑ a b J-Ph. Soulie, G. Renaudin, R. Cerny, K. Yvon: Lithium boro-hydride LiBH4: I. Crystal structure. In: Journal of Alloys and Compounds. Band 346, Nr. 1–², 18. November 2002, S. 200–205, doi:10.1016/S0925-8388(02)00521-2.
- ↑ a b c d e f g h i Eintrag zu Lithiumborhydrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 793.
- ↑ Peter Rittmeyer, Ulrich Wietelmann: Hydrides. In Ullmann's Encyclopedia of Industrial Chemistry. 2002, Wiley-VCH, Weinheim, doi:10.1002/14356007.a13_199.
- ↑ a b Patentanmeldung DE10302262A1: Verfahren zur Herstellung von Lithiumborhydrid. Angemeldet am 22. Januar 2003, veröffentlicht am 5. August 2004, Anmelder: Chemetall GmbH, Erfinder: Dieter Hauk, Ulrich Wietelmann.





