Lysosomale α-Glucosidase
| GAA | ||
|---|---|---|
| Andere Namen |
Glucosidase, Alpha; Acid; Aglucosidase alfa; Acid Maltase; EC 3.2.1.20; Glycogen Storage Disease Type II; Lysosomal Alpha-Glucosidase; Pompe Disease; LYAG | |
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 952 Aminosäuren, 105324 Da | |
| Bezeichner | ||
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.2.1.20, Glykosidase | |
| Reaktionsart | Hydrolyse | |
| Substrat | endständige 1,4-verbundene α-D-Glucosereste | |
| Produkte | α-D-Glucose | |
| Vorkommen | ||
| Homologie-Familie | saure Maltase | |
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2548 | 14387 |
| Ensembl | ENSG00000171298 | ENSMUSG00000025579 |
| UniProt | P10253 | P70699 |
| Refseq (mRNA) | NM_000152 | NM_001159324 |
| Refseq (Protein) | NP_000143 | NP_001152796 |
| Genlocus | Chr 17: 80.1 – 80.12 Mb | Chr 11: 119.27 – 11.93 Mb |
| PubMed-Suche | 2548 | 14387
|
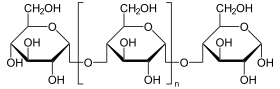
Die lysosomale α-Glucosidase (auch saure Maltase, Gen: GAA) ist dasjenige Enzym, das in Lysosomen langkettige Polysaccharide zu Glucose abbaut. Es ist kein Teil des Glykogenabbaus in der Leber und auch kein Teil der Verdauung von Polysacchariden im Darm (wie die Maltase-Glucoamylase), sondern hilft beim Abbau von Fremdstoffen in den Lysosomen. Die saure Maltase kommt in Wirbeltieren vor. Beim Menschen ist sie in allen Gewebetypen lokalisiert. Mutationen am GAA-Gen können zur Glykogenspeicherkrankheit Typ II (Morbus Pompe) führen.[1]
Ein potenter Hemmstoff der sauren Maltase ist das natürlich vorkommende Salacinol.[2]
Katalysierte Reaktion
Endständige Glucose wird von Polysacchariden abgespalten.
Einsatz als Arzneimittel
Der Wirkstoff wird als Orphan-Arzneimittel zur Behandlung von Morbus Pompe eingesetzt. Das Bundesgericht (Schweiz) urteilte im Jahr 2010, dass das Medikament aus Kostengründen nicht kassenpflichtig ist, weil es damals nicht auf der Spezialitätenliste geführt war.[3][4]
Weblinks
Einzelnachweise
- ↑ UniProt P10253
- ↑ Minami Y, Kuriyama C, Ikeda K, et al: Effect of five-membered sugar mimics on mammalian glycogen-degrading enzymes and various glucosidases. In: Bioorganic & Medicinal Chemistry. 16, Nr. 6, März 2008, S. 2734–40. doi:10.1016/j.bmc.2008.01.032. PMID 18258441.
- ↑ Tomas Poledna, Marianne Tschopp: Der Myozyme-Entscheid des Bundesgerichts. In: Jusletter 7. Februar 2011.
- ↑ im Auszug auch publiziert als BGE 136 V 395