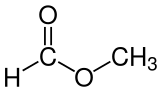
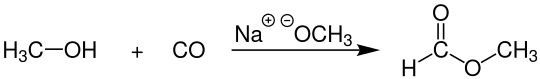Ameisensäuremethylester
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ameisensäuremethylester | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | C2H4O2 | ||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit angenehmem Geruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 60,05 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Dichte |
0,97 g·cm−3 [1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
32 °C[1] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit |
| ||||||||||||
| Brechungsindex |
1,344 (20 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK | |||||||||||||
| Toxikologische Daten | |||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
−386,1 kJ/mol[5] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Ameisensäuremethylester (nach IUPAC-Nomenklatur: Methylmethanoat, auch als Methylformiat bekannt) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Carbonsäureester.
Gewinnung und Darstellung
Industrielle Synthese
Methylformiat wird großtechnisch durch Carbonylierung von Methanol mit Kohlenstoffmonoxid bei Temperaturen von 70–100 °C und Drücken von 50–65 bar hergestellt. Als Katalysatoren werden meist Metallalkoholate wie Natrium- oder Kaliummethanolat eingesetzt. Die komplette Reaktion verläuft dabei in einer Kaskade aus Blasensäulenreaktoren, bei denen das flüssige Methanol im Gleichstrom gegen das Kohlenmonoxidgas geführt wird. Die Aufarbeitung erfolgt durch Destillation mithilfe einer Rektifikationskolonne.[6]
Labormaßstab
Im Labor können kleinere Mengen durch säurekatalysierte Veresterung von Ameisensäure mit Methanol synthetisiert werden, jedoch nur mit begrenzter Ausbeute.
In neueren Arbeiten wird Methylformiat durch oxidative Kopplung von Methanol an nanoporösem Gold als Katalysator bei niedrigen Temperaturen und mit hoher Selektivität erhalten.[7][8]
Eigenschaften
Physikalische Eigenschaften
Methylformiat hat eine Dichte von 0,97 g·cm−3 bei 20 °C, eine relative Gasdichte von 2,07 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,66 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Bei 20 °C weist er einen Dampfdruck von 638 hPa (950 hPa bei 30 °C und 1400 hPa bei 40 °C) auf.[1]
Chemische Eigenschaften
Ameisensäuremethylester ist eine extrem entzündbare Flüssigkeit aus der Stoffgruppe der Carbonsäureester. Der Ester löst sich bei 20 °C mit 300 g/l gut in Wasser, wobei er hydrolysiert wird. Außerdem weist eine Lösung von 200 g·l−1 bei einer Temperatur von 20 °C einen pH-Wert von 4 - 5 auf.[1]
Verwendung
Methylformiat wird als Lösungsmittel für Fette, Öle, Fettsäuren, Celluloseester und Acrylharze eingesetzt.[1] Des Weiteren ist es ein Zwischenprodukt bei organischen Synthesen (z. B. Formamid und Dimethylformamid) und ist Vorstufe bei der Herstellung von Ameisensäure.[1] Ferner wird Methylformiat als Bindemittel in der Gießereiindustrie verwendet (Beta-Set-Verfahren) und findet als Treibmittel für verschiedene Polymere Anwendung.[9] Weiterhin findet er Anwendung als Kältemittel (R611), sowie als Schädlingsbekämpfungsmittel für Tabak und Trockenfrüchte als auch zur Bekämpfung des Kornkäfers.[10]
Man kann aus Ameisensäuremethylester auch Diphosgen herstellen, indem man es unter UV-Licht chloriert:
Sicherheitshinweise
Methylformiat ist eine extrem entzündbare, leicht flüchtige Flüssigkeit. Die Dämpfe bilden mit Luft explosive Gemische. Die Hauptaufnahmewege von Methylformiat und dessen Dämpfe verlaufen über die Atemwege und die Haut. Akute Hauptwirkungsweisen sind die Reizung von Augen und Atemwege, bei hohen Konzentrationen sind Lungenschädigungen möglich. Methylformiat weist eine untere Explosionsgrenze von ca. 5,0 Vol.-% (120 g/cm3) und eine obere Explosionsgrenze von ca. 23,0 Vol.-% (570 g/cm3) auf. Die Zündtemperatur beträgt 450 °C. Der Stoff fällt somit in die Temperaturklasse T2 und die Explosionsgruppe IIA. Die Grenzspaltweite wurde auf 0,94 mm ermittelt. Mit einem Flammpunkt von −27 °C gilt Methylformiat als sehr leicht entflammbar.[1]
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p q r s t Eintrag zu Methylformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Dezember 2018. (JavaScript erforderlich)
- ↑ Eintrag zu Methylformiat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Dezember 2018..
- ↑ Wilhelm Riemenschneider, Hermann M. Bolt: Esters, Organic. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 30. April 2005, S. 247, doi:10.1002/14356007.a09_565.pub2.
- ↑ Eintrag zu Methyl formate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2018. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ Daniel Schneider, Klaus-Dieter Mohl, Martin Schäfer, Jürgen Paschold, Joaquim Henrique Teles, Stefan Rittinger: Verfahren zur Herstellung von Methylformiat durch Umsetzung von Methanol mit Kohlenmonoxid in Gegenwart eines Katalysatorsystems, das Alkaliformiat und Alkalialkoholat enthält. In: Google Patents. BASF SE, 18. Januar 2017, abgerufen am 2. April 2019.
- ↑ Portal für organische Chemie: Goldkatalyse
- ↑ A. Wittstock, V. Zielasek, J. Biener, C. M. Friend, M. Bäumer: Nanoporous Gold Catalysts for Selective Gas-Phase Oxidative Coupling of Methanol at Low Temperature, Science, 327 (2010) No. 5963, S. 319–322; doi:10.1126/science.1183591.
- ↑ Methylformiat rein. In: BASF Produktsuche. BASF SE, 2014, abgerufen am 29. Dezember 2018.
- ↑ Ameisensäure-methylester. In: Chemikalienlexikon. 10. Mai 2000, abgerufen am 29. Dezember 2018.