Molybdän(V)-chlorid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Molybdän(V)-chlorid | ||||||||||||
| Andere Namen |
Molybdänpentachlorid | ||||||||||||
| Summenformel | MoCl5 | ||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff mit stechendem Geruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 273,21 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
2,928 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
268 °C[1] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit |
zersetzt sich in Wasser mit heftiger Reaktion[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Molybdän(V)-chlorid ist eine anorganische chemische Verbindung des Molybdäns aus der Gruppe der Chloride.
Gewinnung und Darstellung
Molybdän(V)-chlorid kann durch Reaktion von Molybdän in sauerstofffreiem Chlor gewonnen werden.[3] Vor der Reaktion sollte das Metallpulver in einem Strom von Wasserstoff oder sauerstofffreiem Stickstoff auf hohe Temperaturen erhitzt werden, um jedes Oberflächenoxid zu entfernen. Es ist danach darauf zu achten, dass vor der eigentlichen Reaktion mit Chlor Luft und Feuchtigkeit vollständig entfernt und von der Reaktion ferngehalten werden.[4]
Es kann auch durch Reaktion von Molybdän(VI)-oxid mit Tetrachlorkohlenstoff unter Druck gewonnen werden.[5]
Eigenschaften
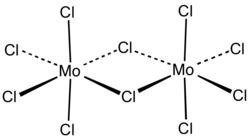
Molybdän(V)-chlorid ist ein nicht brennbarer, äußerst hygroskopischer, blauschwarzer, paramagnetischer Feststoff mit stechendem Geruch, die sich in Wasser mit heftiger Reaktion zersetzt.[1] Hat er eine dunkelgrüne Farbe, so wird diese durch die Anwesenheit von Oxidchloriden verursacht. Die Verbindung ist löslich in Wasser und Alkohol (dunkelgrüne Lösung) unter Solvolyse. Sie ist unzersetzt löslich in organischen Lösungsmitteln wie Ether, Trichlormethan, Tetrachlorkohlenstoff (dunkelrote Lösung), Kohlenstoffdisulfid. Molybdän(V)-chlorid besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12), a = 1731 pm, b = 1781 pm, c = 607,9 pm, β = 95,7°.[3] Sie entspricht nicht der von Niob(V)-chlorid. Neben der α-Form sind auch noch drei weitere Modifikationen bekannt. Die β-Form hat eine trikline Kristallstruktur mit der Raumgruppe P1 (Nr. 2), die γ-Form eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Nr. 62) und die δ-Form eine monokline Kristallstruktur mit der Raumgruppe P21/c (Nr. 14).[6]
Molybdän(V)-chlorid liegt in fester Form als Dimer vor, wohingegen es im gasförmigen Zustand rot aussieht und als Monomer vorliegt.[5]
Verwendung
Molybdän(V)-chlorid wird zur Abscheidung von Molybdän verwendet.[7]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Molybdän(V)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 24. August 2016. (JavaScript erforderlich)
- ↑ Datenblatt Molybdenum(V) chloride, anhydrous bei Sigma-Aldrich, abgerufen am 4. Juli 2013 (PDF).
- ↑ a b Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1534.
- ↑ A. P. Hagen: Inorganic Reactions and Methods, The Formation of Bonds to Halogens. John Wiley & Sons, 2009, ISBN 0-470-14539-0, S. 171 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994, ISBN 3-11-011451-8, S. 662 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. Beck, F. Wolf: Three New Polymorphic Forms of Molybdenum Pentachloride. In: Acta Crystallographica Section B Structural Science. 53, 1997, S. 895–903, doi:10.1107/S0108768197008331.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 281 (eingeschränkte Vorschau in der Google-Buchsuche).

