Muskelfaser


Als Muskelfaser, auch Muskelfaserzelle oder Myozyt, bezeichnet man die spindelförmige zelluläre Grundeinheit der (quergestreiften) Muskulatur des Skeletts. Die Muskelzellen der glatten Muskulatur sind keine Muskelfasern. Die Herzmuskelzellen werden gelegentlich auch als Herzmuskelfasern bezeichnet, sie unterscheiden sich jedoch im Aufbau von den Skelettmuskelfasern.[1]
Muskelfasern enthalten als Träger ihrer Funktion bis mehrere Hundert Muskelfibrillen (Myofibrillen) von je etwa 1 μm (0,001 mm) Durchmesser, welche die Zelle in ganzer Länge parallel zueinander ausgerichtet durchziehen. Abhängig von deren Anzahl messen Muskelfasern im Querschnitt rund 0,01 mm bis 0,1 mm und können, je nach Art und Länge des einzelnen Muskels, wenige Millimeter bis einige Zentimeter lang sein. In einem Skelettmuskel sind mehrere Muskelfasern jeweils zu Faserbündeln (auch „Fleischfasern“ genannt) von 0,1 mm bis 1 mm Durchmesser zusammengefasst, deren Enden in der Regel über Sehnen an Knochen geheftet sind. Diese Skelettelemente können bei einer Muskelkontraktion einander angenähert werden.
Muskelfasern sind mehrkernige zelluläre Gebilde, die durch Verschmelzung von reifen Myoblasten zu langen dünnen Myotuben aus diesen entstehen.
Bauweise
Eine Muskelfaser ist eine lang gestreckte vielkernige Zelle, wobei die Zellkerne meist dicht unter der Zellmembran der Muskelzelle, dem Sarkolemm, liegen. Ausläufer des Sarkolemms stülpen sich an vielen Stellen nach innen mit schlauchartigen Falten ein und bilden damit senkrecht zur Oberfläche und quer zur Längsachse der Muskelzelle ein System von transversalen Tubuli (T-Tubuli, Quer-Tubuli; latein. tubulus 'Röhrchen'), über das auch tief in der Muskelzelle gelegene Bereiche rasch von einer Erregung erreicht werden können, wenn ein Aktionspotential über das Sarkolemm geleitet wird.
Zellmembraneinfaltungen des T-Systems erreichen Calciumspeicher des L-Systems
Die Einstülpungen des T-Systems ziehen hinab bis in die unmittelbare Nähe der Hohlräume eines anderen Röhrensystems, von Ausläufern des (glatten) endoplasmatischen Retikulums (sarkoplasmatisches Retikulum SR). Diese Kammerungen sind nun parallel zur Längsachse der Muskelzelle orientiert – also längs zwischen den Myofibrillen gelegen beziehungsweise sie umgebend – und bilden so ein abgeschlossenes System von longitudinalen Tubuli (L-Tubuli, Längs-Tubuli), das als Reservoir für Calciumionen dient. Zu beiden Seiten stoßen die Ca2+-speichernden Kammern des L-Systems auf die querenden Einfaltungen des T-Systems, sodass der eingefalteten Membran des Sarkolemms beidseits SR-Membranen anliegen (Triade) und Rezeptoren auf den je einander gegenüberliegenden Membranenregionen direkt miteinander in Kontakt treten können.
Elektrische Erregung kann über Calciumionen mechanische Kontraktion auslösen
Wird eine Muskelfaser über die myoneurale Synapse durch eine Nervenzelle erregt – an der motorischen Endplatte durch das zugehörige (untere) Motoneuron seiner motorischen Einheit (mE) – und das Aktionspotential (AP) der Muskelzelle nun über das T-System geleitet, so werden dessen spannungssensitiven (DHPR-)Rezeptoren angesprochen. Ihre Konformationsänderung führt bei Skelettmuskelfasern direkt zu einer Aktivierung der gegenüberliegenden assoziierten (RYR1-)Rezeptoren in der SR-Membran, woraufhin hier Ionenkanäle geöffnet und aus dem L-System Ca2+-Ionen freigesetzt werden, die dann in den Myofibrillen als elektromechanische Koppler eine Kontraktion auslösen: die Muskelfaser verkürzt sich.
Zytoplasma enthält verschiedene Komponenten für Energiebereitstellung
Im Zytoplasma von Muskelfasern befinden sich daneben unterschiedlich zahlreich Mitochondrien (Sarkosomen). In verschiedener Konzentration kann das Sarkoplasma auch als sauerstoffspeicherndes Pigment Myoglobin, energiereiche Substanzen wie Glykogen sowie Enzyme für einen Stoffwechsel aerober Energiegewinnung enthalten, wonach sich unterschiedliche Typen von Muskelfasern auch biochemisch differenzieren lassen.
Hauptbestandteil sind Myofibrillen mit kontraktilen Proteinen
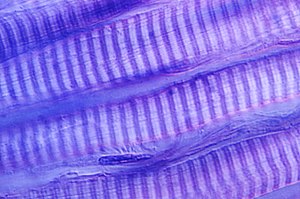
Zur Hauptsache aber enthalten Muskelfasern dicht gepackt und parallel angeordnet einige hundert Myofibrillen (Muskelfibrillen), die sich über die gesamte Länge einer Muskelfaser erstrecken. Eine Myofibrille setzt sich zusammen aus vielen in Längsrichtung aufeinanderfolgenden, scharf abgegrenzten, gleichförmigen Abschnitten, den etwa 2 µm langen Sarkomeren. Sie bilden die eigentlichen kontraktilen Einheiten und zeigen (in polarisiertem Licht) eine typische Querstreifung. Grund dafür ist der hohe Ordnungsgrad der hier im Sarkomer nebeneinander ausgerichteten kontraktilen Proteine. Pro Sarkomer sind jeweils rund 2000 dünne Aktin-Myofilamente und 1000 dickere Myosin-Motorproteine so angeordnet, dass sie sich bei einer Kontraktion gegeneinander verschieben können. Die Aktinfilamente sind durch α-Aktinine (z. B. Alpha-Actinin 3) jeweils in Höhe der Z-Streifen untereinander querverbunden und so zentriert. Elastische Connectinfilamente aus dem Protein Titin verbinden jeweils die Myosinfilamente längs zwischen den Z-Scheiben, stabilisieren so einen Sarkomerkomplex von innen her und bestimmen wesentlich dessen Dehnbarkeit.
Da nicht nur die Myofilamente einer Myofibrille, sondern auch die Myofibrillen in einer Muskelfaser – im Unterschied zur Anordnung in einer glatten Muskelzelle – alle in einer Richtung und streng nebeneinander ziehen, zeigt sich die Querstreifung auch an der gesamten Zelle. Denn in einem Muskelbauch zwischen zwei Anheftungspunkten, Ursprung und Ansatz, eines Skelettmuskels eingespannt arbeiten die Muskelfasern eines Faserbündels nun gleichgerichtet zusammen.
Bindegewebige Umhüllungen (Endo-, Peri- und Epimysium)
Zwischen den Muskelfasern findet sich Bindegewebe als Endomysium, das sie mit der einstrahlenden Sehne verbindet, mehrere Muskelfasern zusammen werden durch ein Perimysium internum bindegewebig gefasst und so als Primärbündel bezeichnet. Einige Primärbündel ergeben zusammen ein Sekundärbündel, wenn sie von einem gemeinsamen Perimysium externum umschlossen werden. Um diese Sekundärbündel spannt sich schließlich das Epimysium, welches den Muskel als ganzen einfasst, geht in die Muskelfaszie über, die auch mehrere Muskeln in einer Muskelloge zusammenfassen kann, und trennt bei Verschiebungen gegenüber der Umgebung. Die Aufgabe der bindegewebigen Strukturen ist es also, den Muskel kraftschlüssig, reißfest und verschieblich abgegrenzt einzubinden sowie seine Versorgung zu sichern. Das Endomysium besteht zum Großteil aus retikulären Fasern, das Perimysium aus parallelen Kollagenfasern. In diesem verlaufen die versorgenden Blutgefäße, ableitenden Lymphgefäße und impulsgebenden Nerven.
Faserarten
Man unterscheidet zwei Haupttypen von Muskelfasern nach ihrer Ausstattung mit Mitochondrien und den Enzymen des aeroben Stoffwechsels sowie ihrem Myoglobingehalt, beziehungsweise nach dem Ablauf der Muskelfaserzuckung. Muskelfasern mit einer relativ höheren Anzahl der genannten Funktionselemente und damit einer besseren Ausrüstung für die längeren Wege eines – verfügbare energiereiche Verbindungen gründlicher ausschöpfenden – oxidativen (sauerstoffverbrauchenden) Stoffwechsels werden Slow-twitch-Fasern genannt (Typ S oder Typ 1) und zucken langsamer. Die schneller zuckenden Muskelfasern benutzen eher die kürzeren Wege anaerober Energiebereitstellung (vorzugsweise aus Glykogen) – haben daher auch einen geringeren Gehalt beispielsweise an sauerstoffspeicherndem rotem Muskelfarbstoff Myoglobin – und heißen Fast-twitch-Fasern (Typ F oder Typ 2). Die Differenz dieser Typen ist eine Anpassung an das vorherrschende Beanspruchungsmuster; sie ist insofern keine Festlegung, als bei anhaltender Veränderung des – durch die AP-Frequenz des zuständigen Motoneurons bestimmten – Aktivitätsmusters einer motorischen Einheit die Muskelfasern eines Typs mit der Zeit in einen anderen Typ umwandelbar sind.[2] Neuere Forschungsergebnisse bei Spitzensportlern im Skilanglauf haben allerdings gezeigt, dass bei entsprechendem Training auch F-Typ-Fasern ein Mitochondrienvolumen und eine Kapillarisierung wie S-Typ-Fasern haben können.[3]
Langsam zuckende Muskelfasern oder S-Fasern (Typ 1)
Typ-S(slow)-Fasern sind langsamer zuckende und damit tendenziell langsam kontrahierende Muskelfasern. Sie verkürzen sich aber immer noch so schnell, dass zyklische Bewegungen mit hohen Wiederholfrequenzen wie etwa Radfahren mit Trittfrequenzen über 100/min möglich sind – und über längere Zeit aufrechterhalten werden können. Sie werden auch dunkle oder rote Fasern genannt, da sie durch die hohe Myoglobinkonzentration eine dunkelrote Färbung besitzen. Sie sind auf Dauerleistung mit begrenztem Kraftaufwand ausgelegt und ermüden nur sehr langsam. Die S-Faser wird von feinen Kapillaren versorgt und gewinnt ihre Energie aerob, wobei der dazu benötigte Sauerstoff dem Blut entnommen wird. Sie werden auch Typ-1-Fasern oder oxidative Fasern genannt.
Schnell zuckende Muskelfasern oder F-Fasern (Typ 2)
Typ-F(fast)-Fasern sind schnell zuckende Muskelfasern. Sie verbrauchen mehr Energie, ermüden rascher und werden auch helle oder weiße Fasern genannt, wegen ihres geringen Myoglobingehaltes, beziehungsweise als Typ-2-Fasern oder glykolytische Fasern bezeichnet. F-Fasern werden zumeist weiter unterschieden in zwei (Unter-)Typen: die in ihren Eigenschaften den S-Fasern ähnlicheren FR(fast-resistant)-Fasern oder Typ-2A und die sehr kräftigen, schnellen, doch rasch ermüdenden FF(fast-fatigue)-Fasern oder Typ-2X bzw. Typ-2B; daneben können weitere Zwischentypen (-2C, -2AC, -2AB) histochemisch (nach Myosin-ATPase-Aktivität) differenziert werden.[4] Diesen Unterschieden entsprechen verschiedene Expressionsmuster der skelettmuskelspezifischen Isoformen von schweren Ketten in Myosin (MyHC-IIa, -IIx, -IIb). Während bei kleineren Säugetieren Typ-2B-Fasern häufig sind, wird die Isoform IIb beim erwachsenen Menschen im schnellen Muskelfasertyp nicht gefunden, doch IIx, weshalb in der neueren Literatur vom Typ-2X gesprochen wird.[5]
Weitere Fasertypen der Skelettmuskulatur
Weitere Fasertypen, einige auch mit spezifischen Myosin-Typen, finden sich beispielsweise in der enormen Kaudruck entwickelnden Kiefermuskulatur (z. B. im Musculus masseter) oder in der schnelle feinste Augenbewegungen ausführenden Muskulatur des Augapfels (z. B. im M. rectus lateralis). Weiterhin besitzt der Fetus eine teilweise spezielle Ausstattung an Myosinen, die manchen Muskelfasern eine eigene Spezifik jenseits der groben Einteilung in S- und F-Fasern ermöglichen.
Physiologie
Entwicklung und Wachstum
Die Skelettmuskulatur der Wirbeltiere geht beidseits längs ihrer primären Achse (Chorda dorsalis) aus dem (paraxialen) Mesoderm hervor, das sich quer in Somiten gliedert und durch induktive Signale ein räumlich orientiertes Muster seiner Lagebeziehungen gewinnt (in drei Dimensionen: dorso-ventrale, anterio-posteriore, medio-laterale Achse). Aus dorsalen Anteilen formieren sich Myotome für Muskulatur mit Muskelvorläuferzellen, von denen einige ortsständig bleiben (spätere autochthone Muskulatur), andere in die Extremitätenanlagen wandern (Zellmigration).
Aus diesen Vorläuferzellen entwickeln sich teilungsfähige unreife und schließliche reife Myoblasten. Diese einkernigen Zellen verschmelzen miteinander (Fusion) zu einem Syncytium mit mehreren Zellkernen und bilden dünne lange schlauchartige Gebilde, die Myotuben. In diesen werden längs der zentralen Kernketten die ersten quergestreiften Myofibrillen gebildet. Mit der Reifung zur Muskelfaser wandern die Zellkerne randwärts und um die Muskelfaser wird die Basalmembran als eigene Umhüllung gebildet, in die auch einige ruhende Myoblasten mit eingeschlossen sind, Satellitenzellen genannt.
Weil die Zellkerne innerhalb einer reifen Muskelfaser nicht mehr teilungsfähig sind, werden diese einkernigen Satellitenzellen für das spätere Wachstum von Muskelfasern wichtig, da über sie zusätzliche Zellkerne integriert werden können bei stärkerer Längen- oder Querschnittszunahme. Hierfür können durch Signale verschiedener Wachstumsfaktoren Satellitenzellen zur Zellteilung gebracht werden; eine Tochterzelle verschmilzt dann mit der Muskelfaser, während die andere sich später eventuell nochmal teilt. Zusätzliche Kerne werden nicht nur gebraucht, wenn sich die Muskelfaser vergrößert, sei es bei normalem Wachstum oder bei einer trainingsbedingten Hypertrophie, sondern auch für mögliche Heilungsprozesse innerhalb der Basalmembranhülle.
Wird ein Muskel nicht mehr eingesetzt, kommt es zur Inaktivitätsatrophie, bei der die Dicke seiner Fasern abnimmt und die Zahl an Satellitenzellen sinkt.
Energiestoffwechsel
Die Mobilisierung, der Transport sowie der Abbau energiereicher Substrate unter ATP-Gewinnung in den Muskelzellen dienen der Ausführung von Muskelarbeit. Siehe dazu den
Kontraktion
Durch Interaktion der beiden Proteine Aktin und Myosin in den Myofilamenten eines Sarkomers kann eine Muskelzelle ihre Länge verringern (konzentrische Kontraktion), gegen Widerstand beibehalten (isometrische Kontraktion) oder ihrer Verlängerung Widerstand entgegensetzen (exzentrische Kontraktion). Im Ruhezustand werden die Stellen des Aktinfilaments, an die sich die Motordomäne von Myosin binden kann, durch ein weiteres Protein, das Tropomyosin, verdeckt. Diese Blockade wird aufgelöst, wenn Calciumionen aus ihrem Speicher im L-System des sarkoplasmatischen Reticulums (SR) ausgeschüttet werden ins Cytosol. Hierzu kommt es, wie erstmals von Setsuro Ebashi in den 1950er Jahren nachgewiesen wurde, nach dem Eintreffen eines Aktionspotentials. Diese Änderung des Membranpotentials wird über die Einfaltungen im T-Systems des Sarkolemms rasch in die Tiefe des Zellinnenraums einer Muskelfaser geleitet und veranlasst die Ausschüttung von Ca2+ längs der Myofibrillen. Dadurch vermittelt kommt es in den Sarkomeren zum Kontakt zwischen Aktin-Filamenten und Motordomänen der Myosin-Filamente sowie durch deren Interaktion als sogenanntes Filamentgleiten zur Kontraktion.
Durch ein einzelnes Aktionspotential wird bei den Skelettmuskeln allerdings nur eine einzelne kurze Muskelfaserzuckung ausgelöst, bei der sich die Muskelfaser nur wenig verkürzt. Um eine stärkere Verkürzung zu erreichen beziehungsweise eine anhaltende Kontraktion hervorzurufen, müssen in rascher Folge Aktionspotentiale eintreffen, damit sich Einzelzuckungen stufenweise überlagern und summiert werden (Superposition). Hiervon zu unterscheiden ist die erst bei noch höherer Aktionspotentialfrequenz auftretende tetanische Kontraktion, bei der es zur völligen Verschmelzung von Einzelzuckungen wie maximal möglicher Kontraktion der Muskelfaser kommt (glatter oder vollständiger Tetanus). Langsam zuckende S-Fasern sind durch Aktionspotential-Serien mit Frequenzen ab etwa 20 Hz tetanisierbar, F-Fasern brauchen hierfür deutlich höhere Frequenzen (über etwa 60 Hz).
Im Muskel wird die Muskelkraft nicht allein über unterschiedliche Impulsfrequenzen der Motoneuronen abgestuft, sondern vornehmlich durch Anzahl und Art der wechselnd (und asynchron) rekrutierten motorischen Einheiten. So sind selbst bei einer geringen Muskelanspannung wie dem reflexbedingten Muskeltonus („Reflextonus“), der beispielsweise einen Körper trotz Schwerkraft unwillkürlich aufrecht halten kann, zumeist keine Einzelzuckungen sichtbar. Auch kommt es bei üblichen Belastungen in vivo nicht zu einem Tetanus des Muskels.
Geschichte
Die Muskelfasern wurden zuerst 1677 von Antoni van Leeuwenhoek beschrieben.[6]
Siehe auch
Quellen
- Renate Lüllman-Rauch: Taschenlehrbuch Histologie. 2. Auflage. Thieme, Stuttgart 2006, ISBN 3-13-129242-3, S. 209–224.
- Stefan Silbernagl, Agamemnon Despopoulos: Taschenatlas der Physiologie. 6., korrigierte Auflage. Thieme, Stuttgart 2003, ISBN 3-13-567706-0, S. 56–73.
Einzelnachweise
- ↑ Walther Graumann: CompactLehrbuch Anatomie. Band 3, Schattauer Verlag, 2004, ISBN 3-7945-2063-7, S. 372.
- ↑ Stefan Silbernagl, Agamemnon Despopoulos: Taschenatlas Physiologie. 8. Auflage. Thieme Verlag, 2012, ISBN 978-3-13-567708-8, S.62.
- ↑ Arnd Krüger (2019). Muskelfasern. Leistungssport 49(1), 15-16; Niels Ørtenblad, Joachim Nielsen, Robert Boushel, Karin Söderlund, Bengt Saltin, Hans-Christer Holmberg (2018). The Muscle Fiber Profiles, Mitochondrial Content, and Enzyme Activities of the Exceptionally Well-Trained Arm and Leg Muscles of Elite Cross-Country Skiers. Front Physiol. 9: 1031. doi: 10.3389/fphys.2018.01031.
- ↑ W. Scott, J. Stevens, S. Binder–Macleod: Human Skeletal Muscle Fiber Type Classifications Archiviert vom Original am 13. Februar 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Physical Therapy. Band 81, Nr. 11, November 2001, S. 1810–1816. Abgerufen am 7. Oktober 2015.
- ↑ B. Harrison, D. Allen, L. Leinwand1: IIb or not IIb? Regulation of myosin heavy chain gene expression in mice and men. In: Skeletal Muscle. Band 1, Nr. 5, Februar 2011. doi:10.1186/2044-5040-1-5.
- ↑ Mr. Leewenhoecks: Mr. Leewenhoecks Letter Written to the Publisher from Delff the 14th of May 1677, Concerning the Observations by him Made of the Carneous Fibres of a Muscle, and the Cortical and Medullar Part of the Brain; as Also of Moxa and Cotton. In: Phil. Trans. 1677 12, S. 899–895. doi:10.1098/rstl.1677.0027 (Volltext)
Weblinks
- Muskelschema – Medizinische Illustration
- Illustration und Funktion
- Insulin-like Growth Factor-1, Mechano Growth Factor und Myosin Schwerketten Transformation beim Krafttraining, Markus Gerd Heinichen (PDF-Datei; 1,98 MB)
- SIB: Animal muscle cell – Muskelzelle, Interaktive Graphik von SwissBioPics