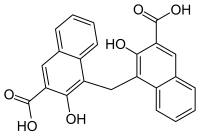
Embonsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Embonsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C23H16O6 | |||||||||||||||
| Kurzbeschreibung |
gelbe Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 388,38 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Embonsäure oder Pamoasäure ist ein Derivat der Naphthalin-2-carbonsäure (2-Naphthoesäure). Sie entsteht bei der Reaktion von 3-Hydroxy-2-naphthalincarbonsäure mit Formaldehyd. Die Salze der Embonsäure werden als Embonate oder Pamoate bezeichnet.
Verwendung
Embonsäure bildet mit basischen Arzneistoffen meist sehr schwer lösliche Salze, aus denen der Wirkstoff nur langsam freigesetzt wird. Derartige Embonate werden daher in der Pharmazie als Depotarzneiformen eingesetzt.
Namensherkunft
Die Bezeichnung Embonsäure ist eine Abkürzung für den chemischen Namen 4,4'-Methylenbis(3-hydroxy-2-naphthoesäure).[4] Die Herkunft des Namens Pamoasäure ist nicht ganz sicher. Wahrscheinlich leitet er sich von dem Antimalaria-Mittel Pamaquin her. Dieses war die erste flüssige Base, die als festes Pamoat eingesetzt wurde.[4]
Einzelnachweise
- ↑ a b c Eintrag zu Embonsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- ↑ a b c Datenblatt Pamoic acid bei Sigma-Aldrich, abgerufen am 30. März 2011 (PDF).
- ↑ a b c P. Heinrich Stahl: Pharmaceutical Salts. Wiley, 2002, ISBN 978-3-906-39026-0, S. 335 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Alexander Senning: Elsevier's Dictionary of Chemoetymology. Elsevier, 2006, ISBN 978-0-080-48881-3, S. 292 (eingeschränkte Vorschau in der Google-Buchsuche).
