Rüsselhündchen
| Rüsselhündchen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Rotschulter-Rüsselhündchen (Rhynchocyon petersi) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Rhynchocyonidae | ||||||||||||
| Gill, 1872 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Rhynchocyon | ||||||||||||
| Peters, 1847 |
Die Rüsselhündchen (Rhynchocyon) sind eine Säugetiergattung aus der Ordnung der Rüsselspringer (Macroscelidea). Die fünf Arten der Gattung sind im östlichen und zentralen Afrika beheimatet. Dort bewohnen sie waldreiches Gelände mit geschlossenen Baumkronen und dichtem Laubwerk am Boden. Sie stellen die größten Vertreter der Rüsselspringer dar und haben wie die anderen auch als besonderes Merkmal eine rüsselartig verlängerte Nase. Zudem sind die Vorderbeine gegenüber den langen Hinterbeinen auffallend kürzer, das Merkmal ist aber nicht ganz so deutlich ausgeprägt wie bei den übrigen Rüsselspringern. Die Lebensweise der Rüsselhündchen ist nur teilweise gut untersucht. Sie sind territorial und leben in monogamen Paarbeziehungen, die über das gesamte Leben halten. Die Nahrung besteht aus einer Vielzahl an Wirbellosen und wird am Boden gesucht, manchmal auch ausgegraben. Charakteristisch sind die aus Pflanzenteilen gebauten Nester, die den Tieren als Unterschlupf dienen. Die Fortpflanzung erfolgt ganzjährig, ein Wurf besteht aus einem bis drei Jungtieren. Muttertiere besuchen ihren Nachwuchs nur kurzzeitig am Tag zum Säugen, eine Beteiligung des Vatertiers an der Aufzucht findet nicht statt. Die Entdeckung der Rüsselhündchen für die Wissenschaft gelang dem deutschen Naturforscher Wilhelm Peters während seiner Reise durch das südliche Afrika in den 1840er Jahren, er beschrieb sie in der Folge als eigene Gattung. Die Stammesgeschichte ist weniger gut erforscht, es konnten bisher nur vereinzelte Fossilfunde aufgefunden werden. Alle heutigen Arten sind gegenwärtig in ihrem Bestand mehr oder weniger bedroht.
Merkmale
Habitus


Die Rüsselhündchen stellen die größten Vertreter der Rüsselspringer dar. Ihre Gesamtlänge variiert von 43,9 bis 50,9 cm beim Gefleckten Rüsselhündchen (Rhynchocyon cirnei) bis zu 55 bis 58 cm beim Graugesichtigen Rüsselhündchen (Rhynchocyon udzungwensis). Die Kopf-Rumpf-Länge liegt für die gesamte Gattung bei 21,8 bis 31,8 cm. Der Schwanz wird zwischen 21,3 und 27 cm lang und erreicht somit 85 bis 90 % der Länge des restlichen Körpers.[1] Das Körpergewicht schwankt von 320 bis 750 g. Äußerlich charakteristische Merkmale finden sich in dem insgesamt schmalen Körperbau mit dem aufgewölbten Rücken und dem im Vergleich zu anderen Rüsselspringern verhältnismäßig kleineren Kopf, der aber ebenfalls über eine rüsselartig verlängerte Nase verfügt, die sehr beweglich ist. Die Beine sind lang und dünn, wobei die Hinterbeine länger als die Vorderbeine sind. Das Merkmal ist aber nicht ganz so deutlich ausgeprägt wie bei den übrigen Rüsselspringern. Im Habitus erinnern die Rüsselhündchen dadurch weniger an ihre maus- und rattenähnlichen Verwandten, sondern eher an sehr kleine Huftiere.[2][3][4]
Das Fell ist lang und gröber als bei den anderen Rüsselspringern, dafür aber vielfältiger in der Farbgebung und teils glänzend. Das typische Fleckenmuster des Gefleckten Rüsselhündchens kann mitunter sehr schwach auch bei den anderen Arten ausgebildet sein. Die Augen sind groß und besitzen gerundete Pupillen. Die Ohren werden aufrecht gehalten, die Ohrmuschel ist nackt. Ebenso besitzt der Schwanz nur eine spärliche Fellbedeckung und wirkt dadurch rattenähnlich. Vorder- und Hinterfüße sind mit jeweils vier Zehen ausgestattet, der innerste Zeh ist zurückgebildet. Am Vorderfuß sind die Strahlen zwei bis vier besonders lang ausgebildet, der äußere, fünfte Strahl steht dagegen weit zurück. Am deutlich verlängerten Hinterfuß, der in etwa die Länge des Unterschenkels erreicht, ragt dagegen der Mittelstrahl (III) am weitesten hervor, die innen und außen anliegenden Strahlen (II und IV) sind etwas kürzer, während der äußerste analog der Hand auch der kürzeste ist. Alle Zehen besitzen lange und kräftige Krallen, die am vorderen Fuß stärker gebogen sind als am hinteren.[5] Weibchen besitzen zwei Paar Zitzen, die sich im Bauch- und Beckenbereich befinden.[6] Bei allen Tieren sind zudem Drüsen in der Steißgegend ausgebildet.[3][7][4]
Schädel- und Gebissmerkmale
Der Schädel wird zwischen 62 und 71 mm lang, an den Jochbögen ist er 33 bis 38 mm breit. Er besitzt in der Seitenansicht eine domartige Aufwölbung an der Stirnlinie, in der Aufsicht wirkt er dreieckig und plattgedrückt breit. Hervorgerufen wird dies durch das sehr breite Stirnbein, das seitlich über dem Augenfenster hängt und seitlich das Nasenbein umfährt. Das Nasenbein zeigt sich entsprechend den anderen Rüsselspringern sehr langgezogen, die Spitze ist aber im Unterschied zu den Verwandten verknöchert. Durch die breite Gestaltung des Schädels entsteht auch ein weiter Naseninnenraum. Das Hinterhauptsbein ist eingezogen und nicht gewölbt wie bei den anderen Vertretern der Familie. Ein deutlicher Unterschied zu den sonstigen Rüsselspringern findet sich im Gaumenbein der Schädelunterseite, das keine paarigen Gaumenfenster aufweist.[8] Charakteristische Merkmale liegen auch im Gebissaufbau vor. Die Zahnformel der Rüsselhündchen lautet: . Insgesamt besteht das Gebiss somit aus 34 bis 36 Zähnen. Die oberen Schneidezähne sind zumeist zurückgebildet, gelegentlich tritt ein einzelner Zahn auf. In diesem Fall ist er klein und funktionslos. Derartige rudimentäre Zähne können sowohl ein- als auch beidseitig ausgebildet sein. An den unteren Schneidezähnen fallen die eingedellten Spitzen auf. Der obere Eckzahn ist stark vergrößert und säbelartig nach hinten gebogen. Hier kann auch ein Geschlechtsdimorphismus beobachtet werden, da der Zahn bei Männchen durchschnittlich größer als bei Weibchen ist. Im Oberkiefer besteht zum hinteren Gebiss eine kleine Lücke. Die Backenzähne haben moderat hohe Zahnkronen (hypsodont), die Kauoberfläche der Molaren sind dilambdodont gestaltet, sie sind also mit zwei Λ-förmige Rippeln ausgestattet. Die Länge der oberen Zahnreihe beträgt 23,5 bis 32,5 mm.[1][3][7][4]
Verbreitung und Lebensraum
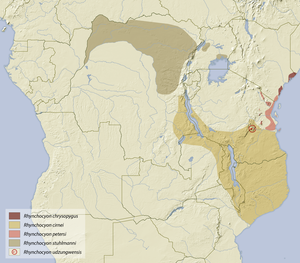
Die Rüsselhündchen leben im zentralen und östlichen Afrika, ihr Verbreitungsgebiet reicht vom Norden und Osten der Demokratischen Republik Kongo über Uganda, Kenia bis Malawi und das nördliche Mosambik. Sie kommen in der Regenwaldzone im Kongobecken ebenso vor wie in Teilen der Somalia-Massai-Buschlandzone und im Bereich der Küstenwälder sowie der Sambesi-Waldlandzone im östlichen Afrika. Ihr Lebensraum besteht dadurch hauptsächlich aus tropischen Regenwäldern, teils laubwerfenden Wäldern oder Waldländern und Uferdickichten der Tief- und Bergländer. Gebirgige Regionen, in denen die Rüsselhündchen auftreten, umfassen den Ostafrikanischen Graben und die Eastern Arc Mountains.[9] Häufig sind geschlossene Kronendächer, dichtes Unterholz und eine dicke Laubschicht am Boden Voraussetzung für die Anwesenheit der Tiere. In Gebieten mit einem dichteren Bestand an Rüsselhündchen zeichnet sich der Boden durch eine lehmige oder sandige Beschaffenheit aus beziehungsweise wächst auf Korallenkalken. Selten besitzt der Untergrund aber hochstehendes Grundwasser.[2] In ihrem Verbreitungsgebiet treten die Rüsselhündchen zumeist in einer geringeren Populationsdichte auf, die niedriger ist als die der in einigen Landschaften sympatrisch auftretenden Rüsselratte (Petrodromus).[3][7][4]
Lebensweise
Territorialverhalten
Die Lebensweise der Rüsselhündchen ist nur beim Goldenen Rüsselhündchen gut erforscht. Sie sind tagaktiv und reine Bodenbewohner, die sich dort vierfüßig laufend und springend mit zum Teil hohen Geschwindigkeiten fortbewegen (cursorial).[10] Beim Laufen verwenden sie einen an Paarhufer erinnernden Zehengang, teilweise kommen auch hohe Sprünge vor, etwa bei der Flucht vor Fressfeinden, was mitunter an Springböcke erinnert. Generell sind die Tiere sehr aufmerksam und alarmbereit, was sie ihren gut entwickelten Sinnesorganen verdanken. Als Unterschlupf dienen Nester aus Pflanzenmaterial. Für diese graben die Tiere kleine, flache Bodenmulden, die sie mit Blättern auskleiden. Die einzelnen Individuen leben territorial und nutzen Reviere von 1 bis 5 ha Größe, die sie mit dem Sekret ihrer Duftdrüsen am Steiß markieren. Spezielle Pfade, wie sie bei einigen Vertretern von Macroscelides und der Elefantenspitzmäuse nachgewiesen sind, legen die Rüsselhündchen aber nicht an. Wie bei anderen Rüsselspringern auch bilden die Tiere monogame Paare, bei denen sich die Territorien vollständig überlappen können. Die gemeinsamen Aktivitäten sind aber auf die Paarungszeit beschränkt, ansonsten gehen die Partner ihre eigenen Wege. Eindringlinge in die jeweiligen Territorien werden immer vom Tier des gleichen Geschlechts vertrieben. Die Kommunikation erfolgt unter anderem durch ein rhythmisches Schlagen mit dem Schwanz auf den Boden und Fußtrommeln mit den Hinterfüßen auf dem Untergrund, was hauptsächlich in Stresssituationen stattfindet.[11][3][2][4]
Ernährung
Die Nahrung der Rüsselhündchen ist im Gegensatz zu den Elefantenspitzmäusen weniger stark auf Insekten ausgerichtet, sie vertilgen vielmehr eine große Bandbreite und Vielzahl an Wirbellosen, die neben Käfern und Ameisen auch Spinnen, Regenwürmer sowie Hundert- und Tausendfüßer umfassen. Teilweise gehen sie auch sehr selektiv vor und entnehmen von einzelnen Beutetieren größere Mengen als sie natürlich in der Umgebung vorkommen. Dadurch kann es regional zu positiven Übereinstimmungen zwischen der Häufigkeit der Rüsselhündchen und einzelner Wirbelloser kommen. Die Nahrung suchen die Tiere generell am Boden in Blätterhaufen und ähnlichem. Teilweise graben sie auch kleine Löcher nach Würmern oder nach anderer, im Erdreich lebender Beute. Die Nase wird bei der Suche sondierend eingesetzt, zur anschließenden Aufnahme der Beute dient die lange Zunge, die mehrere Millimeter vor die Nase herausgestreckt werden kann. Der Stoffwechsel der Rüsselhündchen ist im Unterschied zu den anderen Vertretern der Rüsselspringer kaum untersucht, was auf die bisher auftretenden Schwierigkeiten bei der Haltung in menschlicher Obhut zurückzuführen ist.[11][3][2][4]
Fortpflanzung
Die Paarung erfolgt wahrscheinlich das ganze Jahr über, es ist überwiegend die einzige Phase mit einer koordinierten gemeinsamen Tätigkeit der gebundenen Partner. Nach rund 40 bis 42-tägiger Tragzeit kommt ein einzelnes Jungtier zur Welt, die Wurfgröße kann aber auch bis zu drei Junge betragen. Ein Jungtier wiegt rund 80 g und ist wenig weit entwickelt (Nesthocker) mit nur teilweise ausgebildetem Fellkleid und geschlossenen Augen. Es bleibt rund zwei Wochen in einem eigenen Nest versteckt. Das Muttertier besucht es nur einmal oder mehrmals kurz am Tag zum Säugen. Allgemein wird diese Art der Aufzucht als „System des Absentismus der Mutter“ bezeichnet. Sie ist auch bei anderen Rüsselspringern nachgewiesen, möglicherweise hilft es dabei, die Jungen weitgehend geruchsneutral zu halten und so besser vor Fressfeinden zu schützen.[12] Eine Beteiligung des Vatertiers an der Aufzucht findet nicht statt, eventuell ist es aber indirekt durch Vertreiben von Beutegreifern beteiligt. Höchstwahrscheinlich ist das Junge nach Verlassen des Nestes bereits entwöhnt, da säugende Muttertiere in freier Wildbahn außerhalb des Nestes bisher nicht beobachtet wurden. Das Junge wird in den darauffolgenden Tagen zunehmend unabhängiger und versucht nach spätestens 20 Wochen ein eigenes Territorium zu etablieren. Da der Abstand zwischen zwei Geburten etwa 80 Tage beträgt – Weibchen sind zumeist kurz nach der Geburt wieder empfangsbereit –, können weibliche Tiere je nach äußeren Bedingung zwischen drei und sechsmal im Jahr Nachwuchs zur Welt bringen. Die Lebenserwartung wird auf maximal vier bis fünf Jahre geschätzt, das Höchstalter in menschlicher Obhut betrug etwa 11 Jahre.[13][11][2][3][4]
Systematik
Innere Systematik der Rüsselspringer nach Heritage et al. 2020[14]
|
Die Rüsselhündchern bilden eine Gattung innerhalb der Ordnung der Rüsselspringer (Macroscelidea). Die Ordnung fasst eine Gruppe kleinerer, endemisch in Afrika verbreiteter Säugetiere zusammen. Sie können insgesamt in sechs Gattungen und zwei Familien untergliedert werden.[15] Dabei repräsentieren die Rüsselhündchen den einzigen rezenten Vertreter der Familie der Rhynchocyonidae, welche somit monotypisch ist. Der zweiten Familie, den Macroscelididae, werden dagegen die Rüsselratte (Petrodromus), die Elefantenspitzmäuse (Elephantulus) sowie die Gattungen Macroscelides, Galegeeska und Petrosaltator zugerechnet. Die Rüsselhündchen bilden somit aus phylogenetischer Sicht das Schwestertaxon zu den übrigen Gattungen der Rüsselspringer. Gegenüber den Vertretern der Rhynchocyonidae zeichnen sich die der Macroscelididae durch einen deutlich kleineren Körperbau und eine Anpassung an zumeist offene und trockenere Landschaften aus. Dadurch kommen sie mit einzelnen Ausnahmen in Savannen bis hin zu wüstenartigen Gebieten vor. Neben Körpergröße und Lebensraum finden sich Unterschiede im Skelettbau. Die Rhynchocyonidae besitzen an den Gliedmaßen vorn und hinten jeweils vier Zehen, bei den Macroscelididae liegt die Anzahl bei fünf vorn beziehungsweise vier bis fünf hinten. Im Gebissaufbau unterscheiden sich die Rüsselhündchen durch die reduzierten oder funktionslosen oberen Schneidezähne von den Macroscelididae mit ihren kleinen, aber funktionalen Schneidezähnen. Auch haben erstere einen verlängerten oberen Eckzahn, während er bei letzteren deutlich kleiner und in teils variabler Form ausgebildet ist. Zudem fehlen den Angehörigen der Rhynchocyonidae die Gaumenfenster im Gaumenbein, während diese bei den Vertretern der Macroscelididae deutlich vorhanden sind.[16][7] Weitere definierende Merkmale können in der Weichteilanatomie beobachtet werden. Bei den Rüsselhündchen etwa ist der Penis weniger stark mit Blutgefäßen durchsetzt, während das Ende eine spatelförmige Gestalt besitzt. Dem gegenüber zeichnet sich das männliche Geschlechtsorgan der Macroscelididae durch eine starke Durchblutung und eine abweichende Ausformung der Spitze aus.[17] Letztendlich unterscheiden sich die beiden Gruppen der Rüsselspringer auch in der Lage und Anzahl der Zitzenpaare bei den Weibchen.[6] Die Trennung der Rhynchocyonidae und der Macroscelididae voneinander vollzog sich laut molekulargenetischen Analysen bereits im Unteren Oligozän vor etwa 32,8 Millionen Jahren. Eine stärkere Diversifizierung der Rüsselhündchen erfolgte dann im ausgehenden Mittleren Miozän vor etwa 9,7 Millionen Jahren.[18][14]
Innere Systematik der Rüsselhündchen nach Carlen et al. 2017[19]
|

Es werden gegenwärtig fünf Arten unterschieden:[19][20]
- Goldenes Rüsselhündchen (Rhynchocyon chrysopygus Günther, 1881); in der Küstenregion des südöstlichen Kenia
- Geflecktes Rüsselhündchen (Rhynchocyon cirnei Peters, 1847); vom Osten der Demokratischen Republik Kongo über Malawi und Tansania bis nach Mosambik
- Rotschulter-Rüsselhündchen (Rhynchocyon petersi Bocage, 1880); südöstliches Kenia und nordöstliches Tansania sowie die vorgelagerten Inseln Sansibar und Mafia
- Dunkles Rüsselhündchen (Rhynchocyon stuhlmanni Matschie, 1893); nördliche Demokratische Republik Kongo, Uganda
- Graugesichtiges Rüsselhündchen (Rhynchocyon udzungwensis Rovero, Rathbun, Perkin, Jones, Ribble, Leonard, Mwakisoma & Doggart, 2008); Udzungwa-Berge im zentralen Tansania
Das Dunkle Rüsselhündchen wurde lange Zeit als regionale Unterart des Gefleckten Rüsselhündchens im Kongobecken, R. c. stuhlmanni, geführt. Doch bereits Ende der 1960er Jahre vermuteten einige Wissenschaftler, dass es eventuell eine eigenständige Art darstellt, da die Form äußerlich von den anderen Vertretern der Art auffallend abweicht.[7] Neue molekulargenetische Daten aus dem Jahr 2017 bestätigen diese Ansicht.[19] Als eine möglicherweise sechste Art wurde ein im nordöstlichen Küstengebiet von Kenia im Boni- und Dodori-Nationalreservat vorkommendes Rüsselhündchen interpretiert. Die dortigen Tiere unterscheiden sich durch eine abweichende Farbgebung mit graugelbem Kopf, kastanienbraunen Schultern und Rücken und rabenschwarzen Hinterbeinen markant von den anderen Arten. Ein vermessenes Exemplar besaß eine Gesamtlänge von 54,9 cm, eine Schwanzlänge von 25,6 cm und ein Gewicht von 610 g.[21][22] Genetische Untersuchungen aus dem Jahr 2017, basierend auf einem Individuum, verwiesen die Form in die Nähe des Goldenen Rüsselhündchens,[19] was weitere Analysen aus dem Jahr 2021 bestätigten; seitdem gilt sie als Unterart.[23] Lokal kommt es in den östlichen Bereichen der Udzungwa-Berge zu einer Hybridisierung zwischen dem Gefleckten Rüsselhündchen, dem Rotschulter-Rüsselhündchen und dem Graugesichtigen Rüsselhündchen.[24]
Neben den heutigen Arten ist noch eine fossile anerkannt:
- Rhynchocyon pliocaenicus Butler, 1987
Weitere ausgestorbene Arten waren anfänglich ebenfalls in die Gattung Rhynchocyon gestellt worden, etwa Rhynchocyon clarki und Rhynchocyon rusingae,[25] diese wurden aber 1984 von Percy M. Butler in die neugeschaffene Gattung Miorhynchocyon verschoben.[26]
Forschungsgeschichte
Die Gattung Rhynchocyon erhielt 1847 durch den deutschen Naturforscher Wilhelm Peters ihre wissenschaftliche Erstbeschreibung. Peters befand sich zu dieser Zeit auf seiner Reise durch die südlichen Teile Afrikas, die von 1842 bis 1848 andauerte. Während dieser Zeit beobachtete er in der Nähe von Quelimane im nördlichen Mosambik mehrere Tiere und konnte auch zwei Individuen fangen, ein Männchen und ein Weibchen, die ihm dann zur Benennung der Gattung und zur Einführung des Gefleckten Rüsselhündchens dienten. Der Name Rhynchocyon ist aus den griechischen Wörtern ρύγχος (rhynchos „Rüssel“) sowie κύων (cyon „Hund“) zusammengesetzt. Peters hatte die wissenschaftliche Bezeichnung aufgrund der langen Nase und der großen oberen, hundeähnlichen Eckzähne vergeben. Trotz der offensichtlich nahen Verwandtschaft zu anderen Rüsselspringern, merkte Peters in seiner Erstbeschreibung an, Rhynchocyon habe „im Habitus gar nichts mit den mäuseartigen Macroscelides und Petrodromus gemein“.[27][5]
Im Jahr 1918 führte Oldfield Thomas die Bezeichnung Rhinonax ein, wobei er die Form als Untergattung von Rhynchocyon sah. Unterschiede stellten seiner Meinung nach die teilweise ausgebildeten Oberkieferschneidezähne und das Fehlen des Fleckenmusters auf dem Rücken dar. Somit bildeten das Rotschulter-Rüsselhündchen und das Goldene Rüsselhündchen die Untergattung Rhinonax mit letzterem als Typusform, das Gefleckte Rüsselhündchen dagegen den einzigen Vertreter der Untergattung Rhynchocyon (das Graugesichtige Rüsselhündchen war zu diesem Zeitpunkt unbekannt).[28] In einer Gesamtrevision der Rüsselspringer durch Gordon Barclay Corbet und John Hanks aus dem Jahr 1968 wiesen beide darauf hin, dass das Merkmal der manchmal ausgebildeten Schneidezähne des Oberkiefers bei allen Arten der Rüsselhündchen vorkommt. Daher werden heute innerhalb der Rüsselhündchen keine Untergattungen geführt.[7]
Die Bezeichnung Rhynchocyonidae für die Familie der Rüsselhündchen wurde erstmals 1872 von Theodore Gill erwähnt, damals allerdings auf dem Rang einer Unterfamilie.[29] Zuvor, im Jahr 1855, hatte bereits Paul Gervais die übergeordnete Gruppe als Tribu des Rhynchocyons bezeichnet und von der Tribu des Macroscélidens abgesetzt, was der heutigen Einteilung in die beiden Familien entspricht.[30]
Stammesgeschichte
Die Rüsselhündchen besitzen im Gegensatz zu den Elefantenspitzmäusen nur einen spärlichen Fossilnachweis, die heutigen Vertreter sind fossil gar nicht bekannt. Einen frühen Vorläufer bildet Eorhynchocyon, das mit einigen wenigen Gebissfunden von der Fundstelle Eocliff im Diamantensperrgebiet von Namibia belegt ist und in das Mittlere bis Obere Eozän vor rund 40 Millionen Jahren datiert.[15] Als nächstältere Form kann Oligorhynchocyon aus der Nsungwe-Formation im Rukwa-Becken des südwestlichen Tansanias angesehen werden. Sie ist über einzelne isolierte Zähne belegt, die mit einem Alter von rund 25 Millionen Jahren noch in den spätesten Abschnitt des Oligozäns gehören.[31] Von Miorhynchocyon wiederum sind mehrere Arten aus dem Unteren und Mittleren Miozän vor 20 bis 14 Millionen Jahren in Ost- und Südafrika bekannt. Das Fundmaterial setzt sich aus Schädelteilen, Unterkieferfragmenten, isolierten Zähnen und Teilen des Körperskeletts zusammen. Bedeutende Fossilreste konnten in Songhor, Fort Ternan und auf der Insel Rusinga in Kenia[25][26] entdeckt werden. Charakteristische Unterschiede von Miorhynchocyon gegenüber den heutigen Arten sind die Ausbildung der oberen Schneidezähne und die generell niedrigeren Zahnkronen der hinteren Backenzähne. Allerdings waren die Zahnkronen schon höher als beim älteren Oligorhynchocyon. Teilweise wird der eigenständige Gattungscharakter von Miorhynchocyon angezweifelt und die Form als ältere Version von Rhynchocyon angesehen.[32] Weitere Vorläuferformen aus dem gleichen Zeitabschnitt finden sich mit Brevirhynchocyon und Hypsorhynchocyon wiederum im südlichen Namibia.[33][34][35]
Aus dem westlichen Ägypten wurden einzelne Zähne und Langknochen als zu Rhynchocyon gehörend beschrieben, ohne aber eine genaue Artzuweisung vorzunehmen. Die Funde stammen aus der Karstregion von Sheikh Abdallah in der Libyschen Wüste. Sie werden auf ein Alter von 11 bis 10 Millionen Jahren datiert, einer Zeit als die Region deutlich feuchter war.[36] Näher zu den heutigen Vertretern steht die ausgestorbene Art Rhynchocyon pliocaenicus. Diese konnte bisher nur in Laetoli im nördlichen Tansania, bekannt für seine frühmenschlichen Fußabdrücke, nachgewiesen werden. Sie tritt dort nur in den Upper Laetoli Beds auf, deren Alter bei 3,6 bis 3,5 Millionen Jahren liegt. Es sind rund ein Dutzend Fundstücke entdeckt worden, die sich aus Unter- und Oberkieferteilen sowie einzelnen Wirbeln und Langknochen zusammensetzen. Insgesamt lassen sie auf ein Tier schließen, das etwa 20 % kleiner war als die rezenten Arten. Außerdem wies es im Vergleich zu Miorhynchocyon höherkronige Backenzähne auf, allerdings erinnern noch einige Zahnmerkmale an dieses.[37][32]
Bedrohung und Schutz
Alle Arten der Rüsselhündchen sind in ihrem Bestand mehr oder weniger gefährdet. Laut IUCN ist das Goldene Rüsselhündchen „stark gefährdet“ (endangered), das Rotschulter-Rüsselhündchen und das Graugesichtige Rüsselhündchen gelten als „gefährdet“ (vulnerable), während das Gefleckte Rüsselhündchen als „gering gefährdet“ (near threatened) eingestuft wird. Die Gründe dafür liegen in erster Linie in der fortschreitenden Waldrodung zur Entnahme von Bau- und Brennmaterial oder zur Ausdehnung menschlicher Siedlungen und Wirtschaftsflächen. Die damit einhergehende Zerstörung des Lebensraums führte zur Zerstückelung der Verbreitungsgebiete aller Arten. Dadurch ist auch die mögliche neue, noch unbeschriebene Art an der Nordostküste Kenias bereits in ihrem Bestand gefährdet.[22] In einem weitaus geringeren Maße hat auch die Jagd auf die Tiere für Nahrungszwecke einen Einfluss auf die einzelnen Populationen.[3][38]
Literatur
- Elizabeth J. Carlen, Galen B. Rathbun, Link E. Olson, Christopher A. Sabuni, William T. Stanley und John P. Dumbacher: Reconstructing the molecular phylogeny of giant sengis (Macroscelidea; Macroscelididae; Rhynchocyon). Molecular Phylogenetics and Evolution 113, 2017, S. 150–160 doi:10.1016/j.ympev.2017.05.012
- G. B. Corbet und J. Hanks: A revision of the elephant-shrews, Family Macroscelididae. Bulletin of the British Museum (Natural history) Zoology 16, 1968, S. 47–111
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 ISBN 978-84-16728-08-4
- Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 282–287
- Ronald M. Nowak: Walker's Mammals of the World. Johns Hopkins University Press, 1999 ISBN 0801857899
- Galen B. Rathbun: The social structure and ecology of Elephant-shrews. Zeitschrift für Tierpsychologie Beiheft 20 (Fortschritte der Verhaltensforschung), 1979, S. 1–76
Filmdokumentationen
- Kobolde des Küstenwalds – Die Rüsselhündchen von Arabuko, TV-Dokumentation von Herbert Ostwald, Deutschland 2008, 45 Minuten
Einzelnachweise
- ↑ a b F. Rovero, G. B. Rathbun, A. Perkin, T. Jones, D. O. Ribble, C. Leonard, R. R. Mwakisoma und N. Doggart: A new species of giant sengi or elephant-shrew (genus Rhynchocyon) highlights the exceptional biodiversity of the Udzungwa Mountains of Tanzania. Journal of Zoology 274 (2), 2008, S. 126–133 ([1])
- ↑ a b c d e Galen B. Rathbun: Why is there discordant diversity in sengi (Mammalia: Afrotheria: Macroscelidea) taxonomy and ecology? African Journal of Ecology 47, 2009, S. 1–13
- ↑ a b c d e f g h Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 282–287
- ↑ a b c d e f g Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 ISBN 978-84-16728-08-4
- ↑ a b Wilhelm Peters: Naturwissenschaftliche Reise nach Mossambique: auf Befehl seiner Majestät des Königs Friedrich Wilhelm IV in den Jahren 1842 bis 1848 ausgeführt. Berlin, 1852, S. 1–205 (S. 100–110) ([2])
- ↑ a b Gea Olbricht und William T. Stanley: The topographic distribution of the penis and mammary glands in sengis (Macroscelidea) and its usefulness for taxonomic distinctions. Zoosystematics and Evolution 85 (2), 2009, 297–303
- ↑ a b c d e f G. B. Corbet und J. Hanks: A revision of the elephant-shrews, Family Macroscelididae. Bulletin of the British Museum (Natural history) Zoology 16, 1968, S. 47–111
- ↑ Jan Ihlau, Friederike Kachel und Ulrich Zeller: Graphical description of the ventral side of a sengi's (Macroscelides proboscideus) skull. Afrotherian Conservation 4, 2006, S. 11–12
- ↑ M. Hoffmann, Galen B. Rathbun, F. Rovero, A. Perkin, N. Owen und N. Burgess: The distribution of the genus Rhynchocyon in the Eastern Arc Mountains, with an emphasis on the Blackand-rufous Sengi, Rhynchocyon petersi. Afrotherian Conservation 12, 2016, S. 3–8
- ↑ Barry G. Lovegrove und Metobor O. Mowoe: The evolution of micro-cursoriality in mammals. The Journal of Experimental Biology 217, 2014, S. 1316–1325
- ↑ a b c Galen B. Rathbun: The social structure and ecology of Elephant-shrews. Zeitschrift für Tierpsychologie Beiheft 20 (Fortschritte der Verhaltensforschung), 1979, S. 1–76
- ↑ E. G. Sauer: Zum Sozialverhalten der Kurzohrigen Elefantenspitzmaus Macroscelides proboscideus. Zeitschrift für Säugetierkunde 38, 1973, S. 65–97
- ↑ Gea Olbricht: Longevity and fecundity in sengis (Mavcroscelidea). Afrotherian Conservation 5, 2007, S. 3–5
- ↑ a b Steven Heritage, Houssein Rayaleh, Djama G. Awaleh und Galen B. Rathbun: New records of a lost species and a geographic range expansion for sengis in the Horn of Africa. PeerJ 8, 2020, S. e9652, doi:10.7717/peerj.9652
- ↑ a b Brigitte Senut und Martin Pickford: Micro-cursorial mammals from the late Eocene tufas at Eocliff, Namibia. Communications of the Geological Survey of Namibia 23, 2021, S. 90–160
- ↑ Mike Perrin und Galen B. Rathbun: Order Macroscelidea – Sengis (Elephant-shrews). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 258–260
- ↑ P. F. Woodall: The penis of elephant shrews (Masmmalia: Macroscelididae). Journal of Zoology 237, 1995, S. 399–410
- ↑ H. A. Smit, B. Jansen van Vuuren, P. C. M. O’Brien, M. Ferguson-Smith, F. Yang und T. J. Robinson: Phylogenetic relationships of elephant-shrews (Afrotheria, Macroscelididae). Journal of Zoology 284, 2011, S. 133–143
- ↑ a b c d Elizabeth J. Carlen, Galen B. Rathbun, Link E. Olson, Christopher A. Sabuni, William T. Stanley und John P. Dumbacher: Reconstructing the molecular phylogeny of giant sengis (Macroscelidea; Macroscelididae; Rhynchocyon). Molecular Phylogenetics and Evolution 113, 2017, S. 150–160
- ↑ Galen B. Rathbun: Sengi Taxonomy – a 2017 update. Afrotherian Conservation 13, 2017, S. 9–10
- ↑ Samuel Andanje, Bernard Risky Agwanda, Grace W. Ngaruiya, Rajan Amin und Galen B. Rathbun: Sengi (Elephant shrew) observations from Northern coastal Kenya. Journal of East African Natural History 99 (1), 2010, S. 1–8
- ↑ a b Rajan Amin, Galen B. Rathbun und Samuel Andanje: Conservation concerns for Afrotheria in northern coastal Kenya. Afrotherian Conservation 8, 2011, S. 15–16
- ↑ Bernard R. Agwanda, Francesco Rovero, Lucinda P. Lawson, Cristiano Vernesi und Rajan Amin: A new subspecies of giant sengi (Macroscelidea: Rhynchocyon) from coastal Kenya. Zootaxa 4948 (2), 2021, S. 245–260, doi:10.11646/zootaxa.4948.2.5
- ↑ Lucinda P. Lawson, José Alfredo SamaniegoCastruita, James S. Haile, Cristiano Vernesi, Francesco Rovero und Eline D. Lorenzen: Unraveling elephant-shrews: Phylogenetic relationships and unexpected introgression among giant sengis. Molecular Phylogenetics and Evolution 154, 2021, S. 107001, doi:10.1016/j.ympev.2020.107001
- ↑ a b Percy M. Butler und A. Tindell Hopwood: Insectivora and Chiroptera from the Miocene rocks of Kenya Colony. Fossil Mammals of Africa 13, 1957, S. 1–35 ([3])
- ↑ a b Percy M. Butler: Macroscelidea, Insectivora and Chiroptera from the Miocene of East Africa. Palaeovertebrata 14 (3), 1984, S. 117–200
- ↑ Wilhelm Peters: Eine neue Säugethiergattungen aus den Ordnungen der Insektenfresser. Bericht über die zur Bekanntmachung geeigneten Verhandlungen der Koniglichen Preussischen Akademie der Wissenschaften 1847, S. 36–38 ([4])
- ↑ Oldfield Thomas: Notes on Petrodromus and Rhynchocyon. The Annals and magazine of natural history 9 (1), 1918, S. 364–370 ([5])
- ↑ Theodore Gill: Arrangement of the families of mammals with analytical tables. Prepared for the Smithsonian institution. Smithsonian Miscellaneous Collections 11, 1872, S. 1–98 ([6])
- ↑ Paul Gervais: Histoire naturelle des Mammifères. Paris 1855, S. 1–418 (S. 238) ([7])
- ↑ Nancy J. Stevens, Patrick M. O’Connor, Cassy Mtelela und Eric M. Roberts: Macroscelideans (Myohyracinae and Rhynchocyoninae) from the late Oligocene Nsungwe formation of the Rukwa Rift Basin, southwestern Tanzania. Historical Biology, 2021, doi:10.1080/08912963.2021.1938565
- ↑ a b Patricia A. Holroyd: Macroscelidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 89–98
- ↑ Brigitte Senut: The Macroscelididae from the Miocene of the Orange River, Namibia. Memoir of the Geological Survey of Namibia 19, 2003, S. 119–141
- ↑ Brigitte Senut: Macroscelididae from the lower Miocene of the Northern Sperrgebiet, Namibia. Memoir of the Geological Survey of Namibia 20, 2008, S. 185–225
- ↑ Brigitte Senut und G. Georgalis: Brevirhynchocyon gen. nov., a new name for the genus Brachyrhynchocyon Senut, 2008 (Mammalia, Macroscelidea) preoccupied by Brachyrhynchocyon Loomis, 1936 (Mammalia, Carnivora). Communications of the Geological Survey of Namibia 15, 2014, S. 69
- ↑ H. A. Wanas, M. Pickford, P. Mein, H. Soliman und L. Segalen: Late Miocene karst system at Sheikh Abdallah, between Bahariya and Farafra, Western Desert, Egypt: Implications for palaeoclimate and geomorphology. Geologica Acta 7 (4), 2009, S. 475–487
- ↑ Alisa J. Winkler: Macroscelidea. In: Terry Harrison (Hrsg.): Paleontology and Geology of Laetoli: Human Evolution in Context: Volume 2: Fossil Hominins and the Associated Fauna. Springer Science, 2011, S. 67–74
- ↑ IUCN: The IUCN Red List of Threatened Species. Version 2015.2. ([8]); zuletzt abgerufen am 23. Juli 2015
Weblinks
- California Academy of Sciences: Galerie mit Fotos der Arten