Rubidiumhydrid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
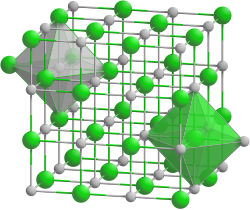
| |||||||
| _ Rb+ _ H− | |||||||
| Kristallsystem |
kubisch | ||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||
| Gitterparameter |
a = 604,9 pm | ||||||
| Allgemeines | |||||||
| Name | Rubidiumhydrid | ||||||
| Verhältnisformel | RbH | ||||||
| Kurzbeschreibung |
farblose prismatische Nadeln[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 86,48 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
2,65 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
reagiert mit Wasser[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Rubidiumhydrid ist eine chemische Verbindung aus Rubidium und Wasserstoff.
Herstellung
Rubidiumhydrid kann durch Reaktion von Rubidium und Wasserstoff hergestellt werden.[4]
Es entsteht auch beim Erhitzen mit Magnesium im Wasserstoffstrom.[5]
Eigenschaften
Physikalische Eigenschaften
Rubidiumhydrid kristallisiert im kubischen Kristallsystem in der Raumgruppe Fm3m (Raumgruppen-Nr. 225) mit den Gitterparametern a = 604,9 pm, und 4 Formeleinheiten pro Elementarzelle.[1]
Chemische Eigenschaften
Beim Erhitzen im Vakuum zersetzt sich Rubidiumhydrid in die Elemente.[4] Die Verbindung ist außerordentlich reaktiv.
Mit Wasser reagiert Rubidiumhydrid unter Bildung von Wasserstoffgas.[1]
Ebenso wird bei der Reaktion mit Chlorwasserstoff Wasserstoff freigesetzt.[1]
Mit Kohlendioxid entsteht Rubidiumformiat.[4]
Mit Schwefeldioxid bildet sich bei Reaktion unter vermindertem Druck Rubidiumdithionit.[4][6]
Mit elementarem Fluor verbrennt Rubidiumhydrid zu Fluorwasserstoff und Rubidiumfluorid. Auch mit elementarem Chlor entzündet sich das Reaktionsgemisch, die Reaktion läuft jedoch nicht vollständig ab und es bleibt ein grünes Mischsalz zurück. Brom und Iod reagieren weniger heftig.[6]
Mit flüssigem Ammoniak bildet sich unter Wasserstoffentwicklung Rubidiumamid, bei Raumtemperatur läuft die Reaktion mit gasförmigem Ammoniak nur sehr langsam ab.[6]
Rubidiumhydrid reduziert beim Erwärmen Blei(II)-oxid zu elementarem Blei, Kupfer(II)-oxid wird zu elementarem Kupfer reduziert.[6]
Einzelnachweise
- ↑ a b c d e f Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 688 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Verlag S. Hirzel, Bd. 2, 1908. S. 425.Volltext
- ↑ J. W. Mellor: "A comprehensive treatise on inorganic and theoretical chemistry", Band 2, Verlag Wiley 1962, S. 2186. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d H. Moissan: "Préparation et propriétés des hydrures de rubidium et de césium" in Compt. Rend. Hebd. 1903, 136, S. 587. Volltext

![{\displaystyle {\ce {Rb2CO3 + Mg + H2 ->[\Delta] 2RbH + MgO + CO2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e55d639f7aaa2262062fce645eb127756fec797f)






