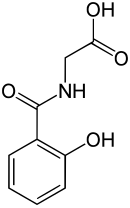
Salicylursäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Salicylursäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H9NO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 195,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
schlecht löslich in Wasser (1,8 g/l bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Salicylursäure (Saliglycinsäure), C9H9NO4, ist ein Amid von Salicylsäure mit Glycin. Chemisch gesehen ist es auch ein Derivat der Hippursäure. Salicylursäure wird in der Leber nach Aufnahme von Salicylsäurepräparaten gebildet, wobei bis zu 70 % der Salicylsäure zu Salicylursäure umgesetzt werden.[2] Sie wird mit dem Harn ausgeschieden.[3]
Salicylursäure kristallisiert aus der heißen wässerigen Lösung in konzentrisch-gruppierten Nadeln aus. Salicylursäure schmeckt bitter, reagiert sauer, löst sich in heißem Wasser, Ethanol und Diethylether.[3] Nachweisbar ist sie in Lösung durch Eisen(III)-Salze, z. B. Eisen(III)-chlorid. Bei positivem Nachweis bilden sich violette Komplexe.[4] Nach langem Kochen zerfällt Salicylursäure in Salicylsäure und Glycin.[3]
Einzelnachweise
- ↑ a b c d e Datenblatt o-Hydroxyhippuric acid, analytical standard bei Sigma-Aldrich, abgerufen am 26. Dezember 2019 (PDF).
- ↑ a b Eintrag zu Salicylsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juni 2014.
- ↑ a b c L. Gmelin: Handbuch der Chemie, Band 6, S. 257–258, Universitäts-Buchhandlung von Karl Winter, 1859.
- ↑ B. Brinkmann (Hrsg.), B. Madea (Hrsg.): Handbuch gerichtliche Medizin Band 2, S. 322, 1. Auflage, Springer Verlag Berlin, 2003, ISBN 978-3-540-66447-5.