Wolfram(VI)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ W6+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Wolfram(VI)-oxid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | WO3 | |||||||||||||||
| Kurzbeschreibung |
zitronengelbes Pulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 231,85 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Wolfram(VI)-oxid, auch Wolframtrioxid (WO3), stellt das wichtigste Oxid des Wolframs dar.
Vorkommen
Wolfram(VI)-oxid kommt natürlich nur mit Kristallwasser in Form der Minerale Elsmoreit (Wolfram(VI)-oxid Halbhydrat), Tungstit (Wolfram(VI)-oxid Hydrat) und Meymacit (Wolfram(VI)-oxid Dihydrat) vor.[5]
Herstellung
Die Gewinnung von Wolframtrioxid erfolgt durch Glühen von Wolfram oder Wolframverbindungen unter Luftzutritt.
Es kann auch durch Reaktion von Natriumwolframat-Dihydrat mit Salzsäure dargestellt werden.[6]
Eigenschaften
Wolfram(VI)-oxid ist ein bei Raumtemperatur intensiv gelb gefärbtes, beim Erwärmen orangefarbenes Kristallpulver. Wolframtrioxid ist in Wasser und Säuren völlig unlöslich, kann aber mit Wasser zu Wolframsäure reagieren. Mit Laugen reagiert es zu Wolframaten.
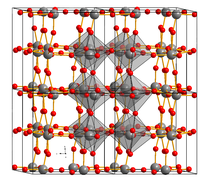
Die Kristallstruktur von WO3 besteht aus WO6-Oktaedern, die in den drei Raumrichtungen über gemeinsame Ecken miteinander verbunden sind. Wie in der Abbildung zu sehen ist, können diese Oktaeder gegeneinander verkippt sein. Dadurch treten bereits unter der Raumtemperatur drei Polymorphe, d. h. unterschiedliche Strukturen, auf. Dabei bleibt es erst bei niedriger Symmetrie und geht von monoklin über triklin wieder zu monoklin über.[7] Erst bei hohen Temperaturen geht es auch in eine orthorhombische und eine tetragonale Phase über.[8] Dabei unterscheiden sich vor allem die Position der Oxidionen geringfügig.
Verwendung
Wolframtrioxid wird in der Keramikindustrie als Kontakt sowie als Gelbpigment verwendet. Eine gewisse Bedeutung könnte WO3 bei der Herstellung ultradünner Oxidfilme erlangen, mit denen sich optische Linsen kratzfest beschichten lassen. Auch elektrochrome Verglasungen enthalten Wolframtrioxid.
Einzelnachweise
- ↑ Eintrag zu TUNGSTEN OXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- ↑ a b c Eintrag zu Wolframoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ a b Eintrag zu Wolframtrioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. November 2007. (JavaScript erforderlich)
- ↑ a b Datenblatt Tungsten(VI) oxide bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- ↑ Mineralienatlas: Tungstit
- ↑ Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1566.
- ↑ H. A. Wriedt: The O-W (oxygen-tungsten) system. In: Bulletin of Alloy Phase Diagrams. 10, 1989, S. 368, doi:10.1007/BF02877593.
- ↑ W. Kleber, M. Hahnert, R. Müller: WO3 - seine Züchtung und kristallographische Untersuchung. In: Zeitschrift für anorganische und allgemeine Chemie. 346, 1966, S. 113, doi:10.1002/zaac.19663460302.
Weblinks
- Peter Pietschmann: Optische Filter. Universität Ulm, Pressemitteilung vom 23. Oktober 1997 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.


