Therapeutisches Drug-Monitoring
Therapeutisches Drug-Monitoring (abgeleitet von englisch therapeutic drug monitoring), kurz TDM, oder Medikamentenspiegelbestimmung (auch Medikamentenüberwachung) ist in der klinischen Chemie und klinischen Pharmakologie die Spiegelbestimmung bestimmter Medikamente im Blut. Der Fokus liegt dabei auf Medikamenten mit einer engen therapeutischen Breite, das heißt Medikamenten, die leicht unter- beziehungsweise überdosiert werden können.[1] TDM zielt darauf ab, die Patientenversorgung mittels individuell angepasster Medikamentendosierung zu verbessern.[2]
Es existieren vielerlei Variablen, welche die Interpretation von Medikamentenspiegeln beeinflussen können: Zeitpunkt, Applikationsform (s.c., p.o., i.m. usw.) und Dosierung des verabreichten Medikamentes, Zeitpunkt der Blutentnahme, präanalytisches Handling der entnommenen Probe, Präzision und Genauigkeit der verwendeten analytischen Methode, Validität der pharmakokinetischen Modelle und Annahmen, Co-Medikation und der klinische Zustand des Patienten (Krankheit, Nieren-/Leberfunktion, Toleranz der Medikation etc.).[3]
Angehörige unterschiedlicher Berufe (Ärzte, klinische Pharmazeuten, Pflegefachkräfte, Labormitarbeiter etc.) sind in die einzelnen Elemente des TDM eingebunden.[4]
Therapeutisches Drug-Monitoring a priori
Beim therapeutischen Drug-Monitoring a priori handelt es sich um die Bestimmung des vorgesehenen Dosierungsschemas, das dem Patienten verabreicht werden soll. Dies basiert auf dem gewünschten Outcome und bekannten pharmakokinetischen-pharmakodynamiusche (PK/PD) Zusammenhängen. Diese ermöglichen es Patienten mit unterschiedlichem Dosierungsbedarf mit Hilfe von demografischen Daten, klinischen Befunden, Labor- oder pharmakogenetischen Resultaten zu identifizieren.[5]
Therapeutisches Drug-Monitoring a posteriori
Beim Konzept des therapeutischen Drug-Monitorings a posteriori handelt es sich um die klinisch übliche Dosisanpassung einer vorhandenen Therapie auf Basis der Messung entsprechender Spiegel- oder Wirkungsmarker.
Definition gemäß der International Association of Therapeutic Drug Monitoring and Clinical Toxicology (IATDMCT):
Das TDM a posteriori
- beinhaltet eine präanalytische, analytische und postanalytische Phase,
- stützt sich auf eine präzise, sensitive und spezifische Messung des gesuchten Medikaments oder seiner aktiven oder toxischen Metaboliten ab,
- verlangt eine Interpretation unter Einbezug der Präanalytik und klinischen Informationen über die Wirksamkeit des Medikaments im Rahmen der verabreichten Dosen beim betroffenen Patienten.
Auf Basis eine populationsbasierten Modellierung der Pharmakokinetik/Pharmakodynamik könnten indivudell angepasste Vorhersagen über die Pharmakokinetik eines Wirkstoffs erfolgen, unter Einbezug der dem Patienten eigenen Pharmakogenetik.[6]
Charakteristika von Medikamenten, die sich für TDM eignen
In der Pharmakotherapie werden viele Substanzen eingesetzt ohne die Überwachung der entsprechenden Blutspiegel, da die entsprechende Dosierung häufig in Funktion der klinischen Entwicklung des Patienten erfolgen kann. Für einige Medikamente ist dieser Ansatz nicht möglich: zu tiefe Spiegel haben einen unzureichenden Effekt oder es kommt zur Resistenzbildung, zu hohe Spiegel können toxisch wirken und zu Endorganschäden führen.
Indikationen für ein Monitoring des Medikamentenspiegels sind:
- konsistente, klinisch validierte pharmakodynamische Zusammenhänge zwischen Medikamentenkonzentration und pharmakologischer Wirkung oder Toxizität;
- signifikante inter-individuelle pharmakokinetische Variabilität, in welcher eine Standarddosierung zu unterschiedlichen Konzentrationsspiegeln in multiplen Patienten führt (während der Medikamentenstoffwechsel in einem gegebenen Patienten stabil bleibt);
- ein enges therapeutisches Fenster, welches eine hohe Dosierung zur Sicherung des gewünschten Effekts bei allen Patienten verunmöglicht;
- Unmöglichkeit der Adjustierung der Medikamentenkonzentration durch klinische Beurteilung alleine;
- Rechtfertigung einer Dosisanpassung wegen Behandlungsdauer und Notwendigkeit der Behandlung beim kritisch kranken Patienten;
- eventuell vorhandene Complianceprobleme.
TDM findet ebenfalls Anwendung in der Diagnostik bei Verdacht auf Medikamentenvergiftung/-überdosierung.
Für weit über 100 Medikamente ist TDM in der Routine möglich. Hier einige Beispiele:
- Aminoglykoside (Gentamicin, Amikacin, Tobramycin, Netilmicin)[7]
- Theophyllin
- Vancomycin (und andere Glykopeptid-Antibiotika)[8]
- Lithium
- Carbamazepin
- Phenobarbital
- Phenytoin
- Valproinsäure
- Lamotrigin
- Amiodaron
- Flecainid
- Digitoxin
- Digoxin
- Cyclosporin
- Tacrolimus
- Everolimus
- Sirolimus
- Methotrexat
- Paracetamol
Die Verwendung von TDM wird zunehmend zum Monitoring unter anderem folgender Substanzklassen verwendet: Antibiotika, Antimykotika, Tyrosinkinaseinhibitoren und andere Krebsmedikamente, TNF-Inhibitoren und andere Biologicals, antiretrovirale Medikamente (bei HIV-Patienten) und Medikamente in der Psychiatrie.[9]
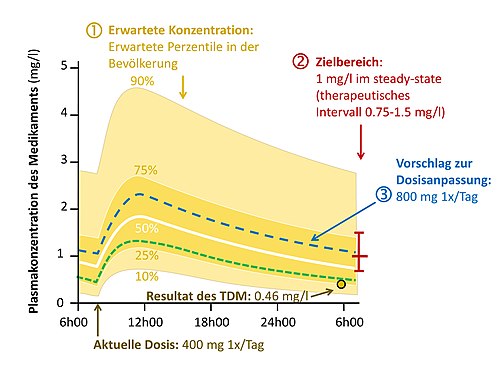
Praktische Anwendung des TDM
Die Interpretation einer Medikamentenkonzentration beinhaltet folgende Schritte:[10]
- Prüfung, ob die gemessene Konzentration im Normbereich liegt.
- Prüfung, ob das gemessene Konzentrationsprofil nahe dem gewünschten Zielbereich liegt.
- Wenn die gemessene Konzentration plausibel, aber weit vom gewünschten Wert entfernt ist, wird festgelegt, wie die Dosis angepasst werden kann, um den gewünschten Zielwert zu erreichen. Hierbei existieren verschiedene Ansätze.[11]
Einzelnachweise
- ↑ S. K. Bangert: Clinical chemistry. 6. Auflage. Mosby, Edinburgh 2008, ISBN 978-0-7234-3455-9.
- ↑ Definitions of TDM &CT. Abgerufen am 3. März 2021.
- ↑ Michael E. Burton: Applied pharmacokinetics & pharmacodynamics: principles of therapeutic drug monitoring. 4. Auflage. Lippincott Williams & Wilkins, Baltimore 2006, ISBN 0-7817-4431-8.
- ↑ Michael E. Burton: Applied pharmacokinetics & pharmacodynamics : principles of therapeutic drug monitoring. 4th ed Auflage. Lippincott Williams & Wilkins, Baltimore 2006, ISBN 0-7817-4431-8.
- ↑ Definitions of TDM &CT. Abgerufen am 16. März 2021.
- ↑ Definitions of TDM &CT. Abgerufen am 16. März 2021.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 334–337 (Spiegelbestimmungen), hier: S. 334 f.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. 2009, S. 335–337.
- ↑ Georgios Schoretsanitis, Michael Paulzen, Stefan Unterecker, Markus Schwarz, Andreas Conca: TDM in psychiatry and neurology: A comprehensive summary of the consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology, update 2017; a tool for clinicians. In: The World Journal of Biological Psychiatry: The Official Journal of the World Federation of Societies of Biological Psychiatry. Band 19, Nr. 3, April 2018, ISSN 1814-1412, S. 162–174, doi:10.1080/15622975.2018.1439595, PMID 29493375.
- ↑ Thierry Buclin, Yann Thoma, Nicolas Widmer, Pascal André, Monia Guidi: The Steps to Therapeutic Drug Monitoring: A Structured Approach Illustrated With Imatinib. In: Frontiers in Pharmacology. Band 11, 2020, ISSN 1663-9812, S. 177, doi:10.3389/fphar.2020.00177, PMID 32194413, PMC 7062864 (freier Volltext).
- ↑ Aline Fuchs, Chantal Csajka, Yann Thoma, Thierry Buclin, Nicolas Widmer: Benchmarking therapeutic drug monitoring software: a review of available computer tools. In: Clinical Pharmacokinetics. Band 52, Nr. 1, Januar 2013, ISSN 1179-1926, S. 9–22, doi:10.1007/s40262-012-0020-y, PMID 23196713.