Chlorphenole
| Chlorphenole | |||||
| Name | 2-Chlorphenol | 3-Chlorphenol | 4-Chlorphenol | ||
| Andere Namen | 2-CP o-Chlorphenol 1-Chlor-2-hydroxybenzol 1-Oxy-2-chlorbenzol |
3-CP m-Chlorphenol 1-Chlor-3-hydroxybenzol 1-Oxy-3-chlorbenzol |
4-CP p-Chlorphenol 1-Chlor-4-hydroxybenzol 1-Oxy-4-chlorbenzol | ||
| Strukturformel | 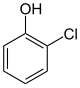
|

|

| ||
| CAS-Nummer | 95-57-8 | 108-43-0 | 106-48-9 | ||
| 25167-80-0 (Isomerengemisch) | |||||
| PubChem | 7245 | 7933 | 4684 | ||
| Summenformel | C6H5ClO | ||||
| Molare Masse | 128,56 g·mol−1 | ||||
| Aggregatzustand | flüssig | fest | |||
| Kurzbeschreibung | farblose Flüssigkeit mit stechendem Geruch |
farblose Kristallnadeln mit phenolartigem Geruch | |||
| Schmelzpunkt | 7 °C[1] | 33–35 °C[2] | 43 °C[3] | ||
| Siedepunkt | 174 °C[1] | 214 °C[2] | 220 °C[3] | ||
| Dichte | 1,26 g·cm−3[1] | 1,25 g·cm−3[2] | 1,31 g·cm−3[3] | ||
| Dampfdruck | 2,3 mbar (20 °C)[1] | 0,23 mbar (20 °C)[2] | 0,15 mbar (20 °C)[3] | ||
| pKs-Wert[4] | 8,48 | 9,08 | 9,38 | ||
| Löslichkeit | wenig löslich in Wasser (27–29 g/l bei 20 °C)[1][2][3] | ||||
| Flammpunkt | 85 °C[1] | 120 °C[2] | 121 °C[3] | ||
| GHS- Kennzeichnung |
| ||||
| H- und P-Sätze | 302‐312‐332‐411 | ||||
| keine EUH-Sätze | |||||
| 273 | 273‐280 | 273‐302+352 | |||
| Toxikologische Daten | 40 mg·kg−1 (LD50, Ratte, oral)[1] | 570 mg·kg−1 (LD50, Ratte, oral)[2] | 670 mg·kg−1 (LD50, Ratte, oral)[3] | ||
Die Chlorphenole bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Phenol als auch vom Chlorbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Hydroxygruppe (–OH) und Chlor (–Cl) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C6H5ClO.
Gewinnung und Darstellung
Alle hier gezeigten Chlorphenole können durch Phenolverkochung der entsprechenden Chloraniline synthetisiert werden.[5][6]
Eigenschaften
Chlorphenole sind schlecht wasserlösliche, schwerflüchtige, giftige, teils krebserzeugende Verbindungen, die häufig als Holzschutzmittel, Herbizide und Fungizide, zum Bleichen von Zellstoff in der Papierherstellung sowie als Zwischenprodukte in der Arzneimittel- und Farbstoffsynthese eingesetzt werden. Da sie chemisch sehr stabil sind, reichern sie sich in der Nahrungskette an. Beim Erhitzen von Chlorphenolen können unter Abspaltung von Chlorwasserstoff polychlorierte Dibenzodioxine entstehen.
Das 4-Chlorphenol, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Die Chlorphenole weisen aufgrund des −I-Effekts des Chlorsubstituenten eine höhere Acidität im Vergleich zum Phenol auf. Die pKs-Werte sind daher entsprechend niedriger (Phenol: 9,99[4]).
Verwendung
2-Chlorphenol wird zur Herstellung von Arzneimitteln und Farbstoffen sowie als Desinfektionsmittel eingesetzt und taucht als Schadstoff im Grundwasser auf. 3-Chlorphenol und 4-Chlorphenol werden als Zwischenprodukte zur Herstellung von Arzneimitteln und Farbstoffen sowie als Desinfektionsmittel eingesetzt.
Weitere Verbindungen
Zur erweiterten Gruppe der Chlorphenole (CP) gehören insgesamt 19 chemische Verbindungen, die durch Substitution der Wasserstoffatome durch Chlor in Phenol hergestellt werden können.
Je nach Anzahl der Chloratome unterscheidet man:
- Monochlorphenole (2-CP, 3-CP, 4-CP)
- Dichlorphenole (2,3-DCP, 2,4-DCP, 2,5-DCP, 2,6-DCP, 3,4-DCP, 3,5-DCP)
- Trichlorphenole (2,3,4-TCP, 2,3,5-TCP, 2,3,6-TCP, 2,4,5-TCP, 2,4,6-TCP, 3,4,5-TCP)
- Tetrachlorphenole (2,3,4,5-TeCP, 2,3,4,6-TeCP, 2,3,5,6-TeCP)
- Pentachlorphenol (PCP)
Bis auf 2-Chlorphenol sind alle Verbindungen der Gruppe bei Raumtemperatur fest.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu 2-Chlorphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Oktober 2012. (JavaScript erforderlich)
- ↑ a b c d e f g h Eintrag zu 3-Chlorphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Oktober 2012. (JavaScript erforderlich)
- ↑ a b c d e f g h Eintrag zu 4-Chlorphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Oktober 2012. (JavaScript erforderlich)
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ R. Schmitt: Ueber die Diazophenole. In: Berichte der deutschen chemischen Gesellschaft. Band 1, Nr. 1, 1868, S. 67–68, doi:10.1002/cber.18680010127.
- ↑ F. Beilstein, Ap. Kurbatow: Ueber den Zusammenhang substituirter Benzole und Phenole. In: Justus Liebigs Annalen der Chemie. Band 176, Nr. 1, 1875, S. 27–54, doi:10.1002/jlac.18751760104.
Weblinks
- Chlorphenole
- „Umweltgifte auf schonende Weise entfernen“, Berliner Zeitung, 12. April 2002.
- Stoffmonografie Chlorphenole – Referenzwerte. Stellungnahme der Kommission „Human-Biomonitoring“ des Umweltbundesamtes (PDF; 1,1 MB) In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. 52, 2009, S. 987–1002, doi:10.1007/s00103-009-0947-9

