Chloraniline
Die Chloraniline bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Anilin als auch vom Chlorbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Aminogruppe (–NH2) und Chlor (–Cl) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C6H6ClN. Daneben existiert auch noch das isomere N-Chloranilin.
Je nach Anzahl der Chloratome (einem, zwei, drei, vier oder fünf) unterscheidet man zudem zwischen Mono-, Di-, Tri-, Tetra- und Pentachloranilinen.
Vertreter
| Chloraniline | ||||||
| Name | 2-Chloranilin | 3-Chloranilin | 4-Chloranilin | |||
| Andere Namen | o-Chloranilin | m-Chloranilin | p-Chloranilin | |||
| Strukturformel | 
|
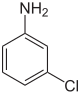
|

| |||
| CAS-Nummer | 95-51-2 | 108-42-9 | 106-47-8 | |||
| PubChem | 7240 | 7932 | 7812 | |||
| Summenformel | C6H6ClN | |||||
| Molare Masse | 127,57 g·mol−1 | |||||
| Aggregatzustand | flüssig | fest | ||||
| Kurzbeschreibung | farblose bis gelbliche Flüssigkeit mit aromatischem Geruch[1][2] |
farbloser bis gelblicher kristalliner Feststoff mit schwach aromatischem Geruch[3] | ||||
| Schmelzpunkt | −3 °C[1] | −10 °C[2] | 70 °C[3] | |||
| Siedepunkt | 209 °C[1] | 230 °C[2] | 232 °C[3] | |||
| Dichte | 1,21 g/cm3[1] | 1,22 g/cm3[2] | 1,43 g/cm3[3] | |||
| Dampfdruck (bei 20 °C) | 0,13 mbar[1] | 0,03 mbar[2] | ||||
| pKs-Wert[4] (der konjugierten Säure BH+) |
2,65 | 3,52 | 4,00 | |||
| Löslichkeit | schwer löslich in Wasser (3–6 g/l)[1][2][3] | |||||
| GHS- Kennzeichnung |
| |||||
| H- und P-Sätze | 331‐311‐301‐319‐373‐410[1] | 301+311+331‐373‐410[2] | 301‐311‐317‐331‐350‐410[3] | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| 261‐273‐280‐301+310‐330‐403+233[1] | 273‐280‐301+310+330‐302+352+312‐304+340+311‐314[2] | 201‐280‐302+350‐304+340‐308+313‐273[3] | ||||
| MAK | Schweiz: 0,04 ml·m−3 bzw. 0,2 mg·m−3 (gemessen als einatembarer Staub)[5] | |||||
Eigenschaften
Das 4-Chloranilin, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Alle Verbindungen dieser Gruppe werden als giftig und umweltgefährlich eingestuft.[6] Chloraniline werden meist als Zwischenprodukte zur Synthese anderer chemischer Verbindungen wie Pflanzenschutzmittel, Farbstoffe und Arzneistoffe eingesetzt. Da beim natürlichen Abbau einiger dieser Stoffe die bei der Synthese eingesetzten Chloraniline freiwerden (bzw. auch bei unsachgemäßer Produktion), sind Spuren der Verbindungen (in den letzten Jahrzehnten in immer geringer werdendem Maße) in Grundwasser und Flüssen zu finden.[7][8] Der Nachweis der Stoffe kann über Flüssigchromatographie erfolgen.[9]
Verwendung
Chloraniline werden meist als Zwischenprodukte zur Synthese anderer chemischer Verbindungen wie Pflanzenschutzmittel, Farbstoffe und Arzneistoffe eingesetzt. 4-Chloranilin darf nach reduktiver Spaltung von Azogruppen nicht von Textilien oder Ledererzeugnissen, die längere Zeit mit der menschlichen Haut direkt in Berührung kommen, freigesetzt werden (Anlage 1 der Bedarfsgegenständeverordnung).
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu o-Chloranilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. März 2020. (JavaScript erforderlich)
- ↑ a b c d e f g h i Eintrag zu m-Chloranilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. März 2020. (JavaScript erforderlich)
- ↑ a b c d e f g h Eintrag zu p-Chloranilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. März 2020. (JavaScript erforderlich)
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach p-Chloranilin), abgerufen am 4. März 2020.
- ↑ Eintrag zu Mono-, Di- und Trichloraniline in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Mai 2008. (JavaScript erforderlich)
- ↑ Organische Schadstoffe im Gebiet der Unteren Mulde. (Memento vom 25. Oktober 2005 im Internet Archive)
- ↑ Jacqueline Burkhardt, Joachim Hörder, Marian Pohl, Walburga Große Wichtrup, Sibylle Wilke: Daten zur Umwelt: der Zustand der Umwelt in Deutschland. Hrsg.: Umweltbundesamt. Erich Schmidt Verlag, Berlin 2005, ISBN 3-503-09057-6, S. 150 (online [PDF]).
- ↑ Verfahren zur Bestimmung von p-Chloranilin. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.


