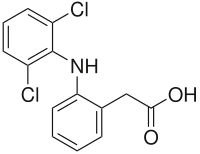
Diclofenac
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Diclofenac | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert |
4,15[2] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (2,37 mg·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Diclofenac (Name abgeleitet von der englischen chemischen Bezeichnung
) ist ein Arzneistoff aus der Gruppe der Nichtopioid-Analgetika, der bei leichten bis mittleren Schmerzen und Entzündungen eingesetzt wird, beispielsweise bei Rheuma, Prellungen, Zerrungen, Hexenschuss, Arthrose, Arthritis und Schweißdrüsenabszessen. Seine Wirkung beruht auf einer nichtselektiven Hemmung der Cyclooxygenasen (COX), die im Körper die Entzündungsmediatoren, die Prostaglandine, bilden. Chemisch gehört es zu den Phenylessigsäuren. In Arzneimitteln wird Diclofenac in Form verschiedener Salze verwendet, z. B. als Natriumsalz oder Diethylammoniumsalz.
Synthese
Alfred Sallmann und Rudolph Pfister synthetisierten in den 1960er-Jahren in der Schweizer J. R. Geigy AG verschiedene substituierte 2-(Phenylamino)phenylessigsäuren, darunter 2-{2-[(2,6-Dichlorphenyl)amino]phenyl}essigsäure. Die Verbindungen wurden als Wirkstoffe gegen Rheumatismus und Arthritis durch Patente geschützt.[4] Anstatt der Decarboxylierung der N-(2,6-Dichlorphenyl)anthranilsäure wird auch eine Reduktion mit Lithiumalanat und Kettenverlängerung mittels Cyanid beschrieben.[5] Die Synthese von Diclofenac wird heute nach einem wesentlich einfacheren Verfahren über 2,6-Dichlordiphenylamin (CAS-Nr. 15307-93-4) aus 2,6-Dichlorphenol über eine Smiles-Umlagerung mit anschließender Stollé-Reaktion mit Chloracetylchlorid durchgeführt (siehe Reaktionsschema).[6] Neun Jahre später wurde dieses komplette Verfahren über einen Phenoxyessigester von einem indischen Unternehmen nochmals angemeldet.[7][8] Teile des Verfahrenspatentes, die Smiles-Umlagerung, wurden von chinesischen Autoren vier Jahre nach der Erstanmeldung beansprucht.[9]
Pharmakologie
Diclofenac hat eine fiebersenkende (antipyretische), schmerzstillende (analgetische), entzündungshemmende (antiphlogistische) und antirheumatische Wirkung. Ursache dafür ist eine Inhibition der Cyclooxygenasen COX-1 und COX-2, die dadurch keine entzündungsfördernden Prostaglandine mehr herstellen können. Möglicherweise ist Diclofenac direkt am Lipoxygenase-Stoffwechsel beteiligt und unterdrückt die Bildung von Leukotrienen.
Anwendung
Anwendungsgebiete
Die häufigste Anwendung von Diclofenac erfolgt bei Schmerzen oder Entzündungen, die in Verbindung mit Verletzungen oder Erkrankungen des Bewegungsapparates entstehen. Gerade in diesem Bereich lassen sich Schmerzen durch Verletzungen oder Entzündungen oft nicht klar gegeneinander abgrenzen. Mögliche Einsatzgebiete für Diclofenac sind akute Gelenkentzündungen einschließlich Gichtanfälle, chronisch verlaufende Entzündungen der Gelenke oder schmerzhafte Schwellungen oder Entzündungen nach Verletzungen oder Operationen. Zusätzlich wird Diclofenac bei entzündlichen Formen des Rheumatismus und bei Weichteilrheumatismus verwendet. Es wird auch als „Schmerzgel“ (bei Schmerzen, Entzündungen und Rheuma) vertrieben.
Diclofenac wurde in dreiprozentiger Konzentration in einer hyaluronsäurehaltigen Gelgrundlage 1998 in Deutschland unter dem Handelsnamen Solaraze zur Behandlung der aktinischen Keratose (AK) zugelassen. Eine Metaanalyse von 2006 zeigte bei 42 von 106 Patienten (39,6 Prozent) nach einer durchschnittlichen Behandlungszeit von 75 Tagen eine vollständige Abheilung der Zielläsionen.[10] Ein Cochrane-Review von 2012 ergab, dass unter den flächentherapeutischen Verfahren die topische Diclofenac-Behandlung der AK vergleichbar gut wirkte wie beispielsweise die mit 5-Fluorouracil, Imiquimod oder Ingenolmebutat.[11] Hyaluronsäure als Trägerstoff soll die Diclofenac-Wirkung bei AK günstig beeinflussen.[12]
Nebenwirkungen
Typische Nebenwirkungen sind Magen- und Darmbeschwerden, die durch eine Hemmung der unter anderem in der Magenschleimhaut vorkommenden COX-1 hervorgerufen werden. Weiterhin können Störungen bei der Blutbildung und Überempfindlichkeitsreaktionen auftreten, etwa Überempfindlichkeit der Haut gegen Sonnenlicht. Zusätzlich kann es zu starken Erhöhungen von Leberwerten (zum Beispiel der Transaminasen) kommen. Da Schwindel und Müdigkeit auftreten können, ist bei der Bedienung von Maschinen und Teilnahme im Straßenverkehr Vorsicht geboten. Bei Verwendung als topisches Arzneimittel zur Behandlung von Sehnenentzündungen (Tennisarm) kann es zu allergischen Reaktionen durch Rötung der Haut unter Schmerzbildung kommen. In Einzelfällen wird die Funktion der Nieren beeinträchtigt (Nephrotoxizität, Analgetikanephropathie, Urämietoxin). Selten führt Diclofenac zu Nesselsucht, sehr selten kommt es zu Haarausfall.[13] Sehr selten treten Herzinfarkte auf.[13] In den Vereinigten Staaten muss laut einer Verfügung der US-amerikanischen Food and Drug Administration in der Fachinformation von auf der Haut anzuwendenden Zubereitungen darauf hingewiesen werden, dass systemische Nebenwirkungen auftreten können.[14]
In sehr seltenen Fällen wirkt Diclofenac bei chronisch entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcerosa) akut schubauslösend. Bei Personen mit Histaminintoleranz kann die allergenspezifische Histaminfreisetzung bei Allergikern gesteigert werden.[15]
2018 zeigte eine Kohortenstudie aus Dänemark:
- Die Inzidenzrate der wichtigsten unerwünschten kardiovaskulären Ereignisse nach 30 Tagen Diclofenac stieg um 50 %, um 20 % gegenüber Ibuprofen oder Paracetamol und um 30 % gegenüber Naproxen.
- Das erhöhte Risiko wurde für Vorhofflimmern oder Flattern, ischämischen Schlaganfall, Herzinsuffizienz, Myokardinfarkt und Herztod beobachtet; beide Geschlechter jeden Alters und sogar bei niedrigen Dosen von Diclofenac.
- Das Risiko einer oberen Magen-Darm-Blutung nach 30 Tagen mit Diclofenac war ähnlich wie bei Naproxen, aber deutlich höher als bei keiner NSAID-Verabreichung, Paracetamol und Ibuprofen.[16]
Bei Hunden treten unter Behandlung mit Diclofenac vermehrt gastrointestinale Nebenwirkungen auf im Vergleich zur Behandlung mit anderen für Hunde zugelassenen nichtsteroidalen Antirheumatika (NSAID).[17]
Wechselwirkungen
Die Anwendung anderer nichtsteroidaler Antirheumatika – wie Acetylsalicylsäure oder Ibuprofen – oder die Einnahme zusammen mit Glucocorticoiden erhöht das Risiko von Nebenwirkungen im Magen-Darm-Trakt. Wechselwirkungen gibt es auch mit Lithium, Phenytoin und Herzglykosiden, deren Serumspiegel durch Diclofenac erhöht werden. Da es sich bei diesen um Substanzen mit einer geringen therapeutischen Breite handelt, kann es zu Überdosierungen kommen. Diclofenac kann die Wirkung von entwässernden und blutdrucksenkenden Arzneimitteln abschwächen.[13]
Bisher konnten in klinischen Untersuchungen keine Wechselwirkungen zwischen blutgerinnungshemmenden Substanzen wie zum Beispiel Phenprocoumon und Diclofenac gefunden werden,[13] dennoch wird empfohlen, bei gleichzeitiger Anwendung den Gerinnungsstatus engmaschig zu kontrollieren.
Gegenanzeigen und Anwendungsbeschränkungen
Eine Gegenanzeige für die Anwendung von Diclofenac liegt vor, wenn eine Überempfindlichkeit gegenüber dem Wirkstoff besteht oder in der Vergangenheit Reaktionen wie Bronchospasmus, Asthma oder Nesselfieber nach der Einnahme anderer nichtsteroidaler Antiphlogistika (NSAP) oder Acetylsalicylsäure bekannt geworden sind. Außerdem sollte Diclofenac nicht vor größeren operativen Eingriffen eingenommen werden, da es die Blutungsgefahr vergrößert. Im letzten Trimenon (3 Monate) einer Schwangerschaft darf Diclofenac nicht eingesetzt werden.
Für die Anwendung von Diclofenac bei Kindern und Jugendlichen gibt es keine ausreichenden Studien, deshalb wird die Anwendung für Patienten unter 15 Jahren nicht empfohlen.
Seit 2005 erschienen verschiedene Arbeiten und Metastudien, die eine Erhöhung des Risikos für einen lebensbedrohlichen Herzinfarkt um den Faktor 1,55 nach der Einnahme von Diclofenac aufzeigten.[18][19] 2012 schloss die europäische Arzneimittelbehörde (EMA) ihre Neubewertung des kardiovaskulären Risikoprofils von NSAR ab.[20] Danach zeigte sich für Diclofenac ein leicht erhöhtes Risiko für kardiovaskuläre Ereignisse. Der Pharmakovigilanzausschuss erarbeitete infolgedessen neue Anwendungshinweise für systemisch anzuwendende Diclofenac-haltige Arzneimittel, wonach Risikopatienten (Herzinsuffizienz der NYHA-Stadien II bis IV, ischämischer Herzerkrankung, peripherer Arterienerkrankung oder einer Erkrankung der Hirngefäße) Diclofenac nicht einnehmen sollen und signifikante Risikofaktoren für Herz- oder Gefäßkrankheiten hinsichtlich der Indikationsstellung besonders zu berücksichtigen sind. Das Risiko für arteriell-thrombotische Ereignisse wurde als dem der COX-2-Hemmer vergleichbar eingestuft.[21][22] Auch in Australien ordnete die staatliche Arzneimittelsicherheitsbehörde TGA (Therapeutic Goods Administration) im April 2015 nach einer Sicherheitsüberprüfung Warnhinweise die kardiovaskulären Risiken betreffend an.[23]
Verwendung in der Tiermedizin
Die Anwendung bei Hunden und Katzen kann massive Magen-Darm-Schädigungen mit teilweise tödlichem Ausgang hervorrufen. Die durch Verabreichung dieses Medikamentes hervorgerufene Schädigung ist einer der häufigsten iatrogenen Notfälle bei Hunden.
Die EU-Rückstandshöchstmengen-Verordnung für Lebensmittel tierischen Ursprungs erlaubt die Anwendung von Diclofenac bei Rindern und Schweinen, wobei für die gewonnenen Lebensmittel Rückstandshöchstmengen festgesetzt sind.
Analytik
Für die zuverlässige qualitative und quantitative Bestimmung des Diclofenac in den unterschiedlichsten Untersuchungsmaterialien wie z. B. Wasser- und Abwasserproben[24][25] oder Fischplasma[26] werden heute die Kopplungsverfahren zwischen HPLC, Gaschromatographie und Massenspektrometrie nach geeigneter Probenvorbereitung eingesetzt.
Auswirkungen auf die Umwelt
70 Prozent des vom Menschen eingenommenen Diclofenacs werden vom Körper über den Urin unverändert wieder ausgeschieden. Da in Deutschland pro Jahr etwa 90 Tonnen des Wirkstoffes verbraucht werden, gelangen auf diesem Weg etwa 63 Tonnen Diclofenac über die Kläranlagen, wo Diclofenac nur zum Teil abgebaut wird, in die Oberflächengewässer und damit in den Wasserkreislauf.[27][28] So wurden im Rahmen einer Studie von 2008 in europäischen Flüssen Diclofenac-Konzentrationen im ein- bis dreistelligen Nanogramm-pro-Liter-Bereich gemessen.[29]
2019 konnte Diclofenac in Österreich in sämtlichen 40 untersuchten Fließgewässern nachgewiesen werden (0,00042–1,1 μg/l).[30] In Toxizitätsstudien wurden für bestimmte Fischarten schädigende Wirkung auf Leber und Nieren nachgewiesen.[28] Bei Forellen z. B. führt bereits ein halbes Mikrogramm Diclofenac pro Liter Wasser zu Nierenschäden.[31]
Die Behandlung von Rindern mit Diclofenac hat unter anderem in Indien in den 1990er-Jahren unerwartet zu einem drastischen Rückgang der Geier-Populationen geführt und Schutzmaßnahmen für die Tiere erforderlich gemacht. Die Vögel nahmen den Wirkstoff über die Haustierkadaver auf. Die betroffenen Geier zeigten zuerst gichtähnliche Symptome, bis sie dann an Nierenversagen starben.[32] Die Anwendung in der Tiermedizin ist in Indien seit März 2005 verboten.[33] Nach der Zulassung von Diclofenac für die Tiermedizin in der EU 2014 wird vor ähnlichen Folgen in Spanien gewarnt, wo die größten Geierpopulationen Europas beheimatet sind.[34] Anstelle von Diclofenac kann das für Geier ungiftige Meloxicam eingesetzt werden.[35][36]
Aufgrund dieser erhöhten Umweltrelevanz gehört Diclofenac zu den sogenannten „Chemicals of Emerging Concern“ (CECs), also Stoffen, die Mensch und Umwelt potenziell erheblich beeinträchtigen können, und wurde in die „Watch List“ prioritär zu überwachender Stoffe der EU aufgenommen.[28][37] Die Predicted No Effect Concentration (PNEC) für Diclofenac liegt bei 0,05 µg/l. In Deutschland wurde 2016 die Diclofenac-Konzentration an 24 Messstellen in Oberflächengewässern analysiert. Dabei wurde die PNEC an 21 der 24 Messstellen überschritten (Jahresmittelwert).[38]
Aufgrund der umweltschädigenden Eigenschaften und des geringen Nutzens von auf der Haut aufzutragenden Diclofenac-Präparaten (Cremes, Gele) riet die schwedische Arzneimittelkommission 2019 von deren Verwendung ab. Nur wenig des Wirkstoffes werde überhaupt resorbiert, sondern der Großteil abgewaschen.[39]
Verkaufsabgrenzung
In Deutschland sind Diclofenac-haltige Arzneimittel verschreibungspflichtig; ausgenommen sind Formulierungen mit einer Diclofenac-Konzentration bis 5 Prozent zur Anwendung auf der Haut und Pflaster zum äußeren Gebrauch ohne weiteren Zusatz arzneilich wirksamer Bestandteile in einer Wirkstoffmenge bis zu 140 mg je abgeteilter Arzneiform. Ferner können perorale Arzneiformen in Einzeldosen bis zu 25 mg je abgeteilter Form und einer Tagesdosis bis maximal 75 mg zur Fiebersenkung (für eine maximale Anwendungsdauer von drei Tagen) und zur Schmerzstillung (für eine maximale Anwendungsdauer von vier Tagen) ohne Rezept bezogen werden.[40]
In Österreich sind Diclofenac-haltige Arzneimittel verschreibungspflichtig, außer für die äußerliche Anwendung gegen Schmerzen und Schwellungen nach stumpfen Verletzungen, Muskelverspannungen und Hexenschuss.[41]
Handelspräparate
Das ursprüngliche Präparat des Unternehmens Geigy trägt den Namen Voltaren (D, A, CH). Weitere Medikamentennamen sind Dedolor (A), Deflamat (A), Deflamm (A), Diclac (D), Diclo (D), Difen-Stulln (CH), Dolpasse (A), Ecofenac (CH), Effigel (CH), Flam-X (CH), Flector (D, CH), Inflamac (CH), Itami (D), Olfen (D, CH), Pennsaid (A), Primofenac (CH), Relowa (CH), Sandoz Schmerzgel (D), Solacutan (D, A, CH; Generikum zu Solaraze[42]), Solaraze (D, A, CH), Tonopan (CH), Tratul (A), Vifenac (CH), Voltadol (A), Voltfast (CH), zahlreiche Generika (D, A, CH)
+ Omeprazol: Arthrocomb (A)
+ Misoprostol: Arthrotec/Arthotec (D, A, CH)
+ Codein: Combaren (D), Voltaren Plus (D)
+ Thiamin, Cyanocobalamin, Pyridoxin: Diclo-B (A), Diclovit (A)
+ Heparin: Flectoparin (CH)
+ Orphenadrin: Neodolpasse (A)
Weblinks
- www.wissenschaft.de: Diclofenac-Salben helfen gegen Kniearthritis
- www.wissenschaft.de: Diclofenac erhöht das Herzinfarktrisiko
- Herz-Kreislauf-Risiko: EU-Behörde warnt vor Schmerzmittel Diclofenac (SPON)
Einzelnachweise
- ↑ Datenblatt DICLOFENAC SODIUM CRS (PDF) beim EDQM, abgerufen am 22. Februar 2009.
- ↑ a b c Eintrag zu Diclofenac in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 19. April 2022.
- ↑ a b Datenblatt Diclofenac sodium salt bei Sigma-Aldrich, abgerufen am 24. März 2011 (PDF).
- ↑ NL 6 604 752 (1966), CH 487 116 (1967) worldwide.espacenet.com; Sallmann A. (Ciba); Verfahren zur Herstellung einer neuen, substituierten Phenylessigsäure; Chem. Abstr. 67: 81 925.
- ↑ Patent CH492679A: Verfahren zur Herstellung von neuen substituierten Phenylessigsäuren. Angemeldet am 30. März 1966, veröffentlicht am 30. Juni 1970, Anmelder: Geigy AG, Erfinder: Alfred Sallmann, Rudolf Pfister (Chem. Abstr. 73:130 782).
- ↑ Patent EP380712B1: Verfahren zur Herstellung von 2,6-Dichlordiphenylaminessigsäurederivaten. Angemeldet am 27. Januar 1989, veröffentlicht am 4. Januar 1995, Anmelder: Heumann Pharma GmbH & Co, Erfinder: Ingomar Grafe, Helmut Schickaneder, Kurt-Henning Ahrens (Chem. Abstr. 113: 190 940).
- ↑ Patent IN178407B: An improved process for the preparation of 2-[2,6-dichlorophenyl)aminobenzene acetic acid-& its salts thereof. Angemeldet am 31. März 1994, veröffentlicht am 19. April 1997, Anmelder: JB Chemical & Pharmaceuticals, Erfinder: Mody Shirish Bhagwanlal, Mehta Bharat Pravinchandra, Shrikhande Atul Anant (Chem.Abstr. 2004: 14 080).
- ↑ Patent IN184848B: A process for the preparation of 2. 6-dichloro substituted diphenylamine derivative. Angemeldet am 5. Juni 1998, veröffentlicht am 30. September 2000, Anmelder: JB Chemical & Pharmaceuticals, Erfinder: Shirish Bhagwanlal Mehta Mody (Chem. Abstr. 2004: 874 703).
- ↑ Patent CN1091420A: Preparation method of diphenylamine derivant. Angemeldet am 25. Februar 1993, veröffentlicht am 31. August 1994, Anmelder: Yongxin Medicines and Chemical, Erfinder: Li Fangquan, Liu Congzhong (Chem.Abstr. 1995: 994 467).
- ↑ D. Pirard, P. Vereecken, C. Mélot, M. Heenen: Three percent diclofenac in 2.5% hyaluronan gel in the treatment of actinic keratoses: a meta-analysis of the recent studies. In: Archives of Dermatological Research. 2005, doi:10.1007/s00403-005-0601-9.
- ↑ A. K. Gupta, M. Paquet, E. Villanueva, W. Brintnell: Interventions for actinic keratoses. In: Cochrane Database of Systematic Reviews. 2012, doi:10.1002/14651858.CD004415.pub2.
- ↑ M. B. Brown, S. A. Jones: Hyaluronic acid: a unique topical vehicle for the localized delivery of drugs to the skin. In: Journal of the European Academy of Dermatology and Venereology (JEADV). 2005, doi:10.1111/j.1468-3083.2004.01180.x.
- ↑ a b c d Core Safety Profile – Diclofenac, systemic formulations, Arzneimittelsicherheitsangaben für Fachinformationen in der EU.
- ↑ Voltaren Gel (diclofenac sodium topical gel) 1 % – Hepatic Effects Labeling Changes. 12. April 2009.
- ↑ Reinhart Jarisch: Histamin-Intoleranz, Histamin und Seekrankheit. Thieme 2004, ISBN 3-13-105382-8.
- ↑ Morten Schmidt, Henrik Toft Sørensen, Lars Pedersen: Diclofenac use and cardiovascular risks: series of nationwide cohort studies. In: BMJ., S. k3426, doi:10.1136/bmj.k3426.
- ↑ Julia Nakagawa u. a.: Nebenwirkungen durch nicht zugelassene nichtsteroidale Entzündungshemmer (NSAID) bei 21 Hunden. In: Kleintierpraxis. 55 (2010), S. 364–370.
- ↑ J. Hippisley-Cox, M. Pringle, R. Cater, C. Coupland, A. Meal: Coronary heart disease prevention and age inequalities: the first year of the National Service Framework for CHD. In: Br J Gen Pract. 55(514), Mai 2005, S. 369–375. PMID 15904556.
- ↑ Patricia McGettigan, David Henry: Cardiovascular Risk and Inhibition of Cyclooxygenase. In: JAMA. 296, 2006. doi:10.1001/jama.296.13.jrv60011.
- ↑ European Medicines Agency finalises review of recent published data on cardiovascular safety of NSAIDs (PDF; 70 kB), 19. Oktober 2012.
- ↑ New safety advice for diclofenac – CMDh endorses PRAC recommendation (Neue Sicherheitshinweise für Diclofenac – Koordinierungsgruppe der Länderbehörden befürwortet die Empfehlung des Pharmakovigilanzausschusses), Pressemitteilung der europäischen Arzneimittelagentur vom 28. Juni 2013.
- ↑ Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Rote-Hand-Brief Neue Kontraindikationen und Warnhinweise nach europaweiter Überprüfung der kardiovaskulären Sicherheit, (PDF; 205 kB).
- ↑ Non-steroidal anti-inflammatory drugs and diclofenac reviews, Therapeutic Goods Administration (TGA).
- ↑ D. Simazaki, R. Kubota, T. Suzuki, M. Akiba, T. Nishimura, S. Kunikane: Occurrence of selected pharmaceuticals at drinking water purification plants in Japan and implications for human health. In: Water Res. 76, 1. Jun 2015, S. 187–200. PMID 25835589.
- ↑ I. Nishi, T. Kawakami, S. Onodera: Monitoring the concentrations of nonsteroidal anti-inflammatory drugs and cyclooxygenase-inhibiting activities in the surface waters of the Tone Canal and Edo River Basin. In: J Environ Sci Health A Tox Hazard Subst Environ Eng. 50(11), 2015, S. 1108–1115. PMID 26191985.
- ↑ F. Chen, Z. Gong, B. C. Kelly: Rapid analysis of pharmaceuticals and personal care products in fish plasma micro-aliquots using liquid chromatography tandem mass spectrometry. In: J Chromatogr A. 1383, 27. Feb 2015, S. 104–111. PMID 25640994.
- ↑ Marc Meißner: Arzneimittel in der Umwelt: Natur als Medikamentendeponie. In: Dtsch Arztebl. 105(24), 2008, S. A-1324.
- ↑ a b c Kevin S. Jewell, Per Falås, Arne Wick, Adriano Joss, Thomas A. Ternes: Transformation of diclofenac in hybrid biofilm–activated sludge processes. In: Water Research. 105, 2016, S. 559–567. doi:10.1016/j.watres.2016.08.002.
- ↑ Robert Loos, Bernd Manfred Gawlik, Giovanni Locoro, Erika Rimaviciute, Serafino Contini, Giovanni Bidoglio: EU-wide survey of polar organic persistent pollutants in European river waters. In: Environmental Pollution. 157, 2009, S. 561–568. doi:10.1016/j.envpol.2008.09.020.
- ↑ Manfred Clara, Christina Hartmann, Karin Deutsch: Arzneimittelwirkstoffe und Hormone in Fließgewässern. GZÜV Sondermessprogramm 2017/2018. (bmnt.gv.at [PDF; abgerufen am 2. November 2019]).
- ↑ Antibiotika- und Heilmittelrückstände in der Umwelt: Die versteckte Seite des Medikamentenkonsums. Bundesamt für Umwelt, 26. August 2015, abgerufen am 24. Mai 2020.
- ↑ Devojit Das, Richard J. Cuthbert, Ram D. Jakati, Vibhu Prakash: Diclofenac is toxic to the Himalayan Vulture Gyps himalayensis. In: Bird Conservation International, 2010, S. 1–4
- ↑ Naturschutzbund Deutschland: Katastrophales Geiersterben in Indien.
- ↑ Ralf Streck: Wissenschaftler warnen vor Geiersterben in Spanien. In: Telepolis. 5. April 2014.
- ↑ Michael Hopkin: Switching vet drug could save vultures. In: news@nature. 2006, doi:10.1038/news060130-2.
- ↑ Gerry Swan, Vinasan Naidoo, Richard Cuthbert, Rhys E Green, Deborah J Pain, Devendra Swarup, Vibhu Prakash, Mark Taggart, Lizette Bekker, Devojit Das, Jörg Diekmann, Maria Diekmann, Elmarié Killian, Andy Meharg, Ramesh Chandra Patra, Mohini Saini, Kerri Wolter, Georgina Mace: Removing the Threat of Diclofenac to Critically Endangered Asian Vultures. In: PLoS Biology. Band 4, Nr. 3, 2006, S. e66, doi:10.1371/journal.pbio.0040066.
- ↑ European Comission: Priority substances under the Water Framework Directive.
- ↑ Arzneimittelwirkstoffe. Umweltbundesamt, 15. Mai 2020, abgerufen am 15. Juli 2020.
- ↑ J. Borsch: „Diclofenac-Gel – kleiner Nutzen für Patienten, großer Schaden für die Umwelt“, Deutsche Apothekerzeitung, 10. Januar 2019.
- ↑ Anlage 1 (zu § 1 Nr. 1 und § 5) Stoffe und Zubereitungen nach § 1 Nr. 1
- ↑ Verordnung des Bundesministers für Gesundheit und Umweltschutz vom 30. August 1973 über rezeptpflichtige Arzneimittel
- ↑ Solaraze wird generisch, apotheke adhoc, 11. Oktober 2016.
