1,1,1-Trimethylolpropan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,1,1-Trimethylolpropan | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H14O3 | |||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner Feststoff mit schwachem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,18 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,084 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
295 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
1,1,1-Trimethylolpropan (TMP) ist eine organisch-chemische Verbindung aus der Stoffgruppe der dreiwertigen Alkohole, die in Form eines weißen, brennbaren Pulvers vorliegt.
Gewinnung und Darstellung
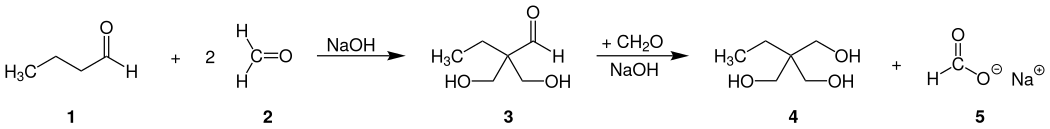
Die technische Herstellung von 1,1,1-Trimethylolpropan erfolgt durch eine doppelte Aldoladdition von n-Butyraldehyd (1) mit Formaldehyd (2), wobei zunächst 2,2-Bis-hydroxymethylbutanal (3) als Zwischenprodukt entsteht. Dieses reagiert anschließend mit überschüssigem Formaldehyd und Einsatz stöchiometrischer Mengen Base in einer gekreuzten Cannizzaro-Reaktion, wobei die Aldehydgruppe zum Alkohol reduziert wird und Trimethylolpropan (4) sowie das entsprechende Formiat (5) gebildet wird.[3]
Als Base wird vorwiegend Natrium- oder Calciumhydroxid verwendet. Gelegentlich werden auch verschiedene Carbonate eingesetzt. Die Ausbeute beträgt in allen Fällen etwa 90 %. Um den großen Anfall an Formiat-Nebenprodukt zu vermeiden, wird die Reduktion der Carbonylgruppe in einigen Prozessen (z. B. BASF) mittels katalytischer Hydrierung realisiert. Als Basen werden tertiäre Amine und Cobalt-Hydrierkatalysatoren eingesetzt.[3]
Jährlich werden weltweit etwa 100.000 Tonnen an Trimethylolpropan hergestellt.[4]
Eigenschaften
1,1,1-Trimethylolpropan besitzt drei Hydroxygruppen und ermöglicht es dadurch, Polymere dreidimensional zu vernetzen. Der Flammpunkt liegt bei 179 °C, die Zündtemperatur bei 375 °C.[2]
Verwendung
1,1,1-Trimethylolpropan wird als Zwischenprodukt bei der Synthese anderer organischer Verbindungen eingesetzt (zum Beispiel Trimethylolpropan-trimethacrylat (TMPTMA), für Polyurethane, Polyesterpolyole und Polyetherpolyole, für Tenside, Bindemittel und Klebstoffe, synthetische Schmierstoffe, Polyester- und Alkydharzlacke). Diese werden in der Möbel-, Bau- und Automobilindustrie genutzt.[5]
Sicherheitshinweise
Trimethylolpropan ist ein brennbarer, jedoch nur schwer entzündbarer Stoff. Er wird als reproduktionstoxisch (Kat. 2) eingestuft, da es vermutlich die Fruchtbarkeit bzw. des ungeborene Kind im Mutterleib schädigt. Trimethylolpropan weist eine untere Explosionsgrenze (UEG) von ca. 1,3 Vol.-% (ca. 72 g/cm3) und eine obere Explosionsgrenze (OEG) von ca. 11,8 Vol.-% auf. Die Zündtemperatur beträgt 375 °C. Der Stoff fällt somit in die Temperaturklasse T2. Mit einem Flammpunkt von 179 °C gilt Trimethylolpropan als relativ schwer entflammbar.[2]
Weblinks
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für 1,3-Propanediol, 2-ethyl-2-(hydroxymethyl)-
Einzelnachweise
- ↑ Eintrag zu TRIMETHYLOLPROPANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. April 2020.
- ↑ a b c d e f g h i j k l Eintrag zu 1,1,1-Trimethylolpropan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Oktober 2020. (JavaScript erforderlich)
- ↑ a b Peter Werle, Marcus Morawietz, Stefan Lundmark, Kent Sörensen, Esko Karvinen, Juha Lehtonen: Alcohols, Polyhydric. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. Juli 2008, S. 14; doi:10.1002/14356007.a01_305.pub2.
- ↑ Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 234.
- ↑ Nachrichten aus der Chemie, 03/2011, S. 219 doi:10.1002/nadc.201179640.