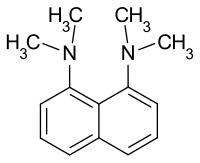
1,8-Bis(N,N-dimethylamino)naphthalin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,8-Bis(N,N-dimethylamino)naphthalin | |||||||||||||||
| Andere Namen |
N,N,N′,N′-Tetramethylnaphthalin-1,8-diamin (IUPAC) | |||||||||||||||
| Summenformel | C14H18N2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 214,31 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
12,34[2] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
1,8-Bis(N,N-dimethylamino)naphthalin ist eine organische Verbindung. Sie wurde erstmals 1968 von Roger Alder[2] an der University of Bristol hergestellt. Sie wird als Modellsubstanz eines Protonenschwammes bezeichnet.[4][5] 1,8-Bis(dimethylamino)naphthalin ist ein aromatisches Diamin, das zwei tertiäre Aminogruppen in benachbarter Position (peri-Position) am Naphthalinring besitzt. Durch diese Stellung ergeben sich eine sehr hohe Basizität (pKa = 12,34) und besondere spektroskopische Eigenschaften.
Struktur und Eigenschaften
Mit einer Basenkonstante pKb von 1,66 (Säurekonstante 12,34)[2] ist 1,8-Bis(dimethylamino)naphthalin eine der stärksten bekannten Aminbasen. Trotzdem werden Protonen nur langsam aufgenommen. Wegen seiner hohen Basizität und geringer Nukleophilie wird es in der organischen Synthese als Mittel zum Deprotonieren organischer Verbindungen genutzt.
Herstellung
Die Verbindung ist kommerziell erhältlich. Sie kann durch Methylierung von 1,8-Diaminonaphthalin mit Methyliodid oder Dimethylsulfat hergestellt werden.[6]
Andere Protonenschwämme
Protonenschwämme der zweiten Generation besitzen eine noch höhere Basizität, ein Beispiel ist 1,8-Bis(hexamethyltriaminophosphazenyl)naphthalin, HMPN: Ein superbasisches Bisphosphazen Proton Sponge[7] wird aus 1,8-Bis(dimethylamino)naphthalin und Tris(dimethylamino)phosphin hergestellt. HMPN hat einen pKBH+ von 29,9 in Acetonitril.
Weblinks
Einzelnachweise
- ↑ a b c Datenblatt N,N,N′,N′-Tetramethyl-1,8-naphthalenediamine bei Sigma-Aldrich, abgerufen am 19. Mai 2017 (PDF).
- ↑ a b c R. W. Alder, P. S. Bowman, W. R. S. Steele und D. R. Winterman: The remarkable basicity of 1,8-bis(dimethylamino)naphthalene. In: Chem. Commun.. 1968, S. 723. doi:10.1039/C19680000723.
- ↑ Eintrag zu 1,8-Bis(dimethylamino)naphthalene bei ChemicalBook, abgerufen am 24. Oktober 2009.
- ↑ F. Gerson, E.Haselbach und G. Plattner: Radical anion of 1,8-bis(dimethylamino)naphthalene (“proton sponge”). (abstract) In: Chem. Phys. Lett.. 12, Nr. 2, Dezember 1971, S. 316–319. doi:10.1016/0009-2614(71)85074-1.
- ↑ A. Szemik-Hojniak, W.Rettig und I. Deperasinska: The forbidden emission of protonated proton sponge. In: Chem. Phys. Lett.. 343, Nr. 3, 3. August 2001, S. 404–412. doi:10.1016/S0009-2614(01)00690-X.
- ↑ Sorokin, Vladimir I.: A Simple and Effective Procedure for the N-Permethylation of Amino-Substituted Naphthalenes. In: European Journal of Organic Chemistry. 2003, 2003, S. 496. doi:10.1002/ejoc.200390085.
- ↑ Volker Raab, Ekaterina Gauchenova, Alexei Merkoulov, Klaus Harms, Jörg Sundermeyer, Borislav Kovačević und Zvonimir B. Maksić: 1,8-Bis(hexamethyltriaminophosphazenyl)naphthalene, HMPN: A Superbasic Bisphosphazene “Proton Sponge”. In: J. Am. Chem. Soc.. 127, Nr. 45, 2005, S. 15738–15743. doi:10.1021/ja052647v.

