Essigsäure-n-butylester
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
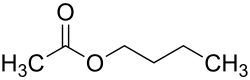
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Essigsäure-n-butylester | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | C6H12O2 | ||||||||||||
| Kurzbeschreibung |
farblose, fruchtartig riechende Flüssigkeit[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 116,16 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
0,88 g·cm−3 (20 °C)[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
127 °C[2] | ||||||||||||
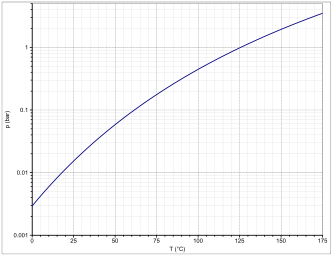
| Dampfdruck | |||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,3941 (20 °C)[4] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Essigsäure-n-butylester, auch Butylacetat oder Butylethanoat, ist ein klares, farbloses Lösungsmittel mit eher angenehmem, fruchtartigem Geruch, das natürlich in vielen Früchten vorkommt und Bestandteil des Apfelaromas ist.[7] Es handelt sich um den Ester der Essigsäure mit 1-Butanol. Neben diesem haben noch die Ester der isomeren Butanole Essigsäure-sec-butylester, Essigsäureisobutylester und Essigsäure-tert-butylester Bedeutung.
Gewinnung und Darstellung
Großtechnisch wird Essigsäure-n-butylester durch säurekatalysierte Veresterung von Essigsäure mit n-Butanol bei Temperaturen von 80–120 °C hergestellt. Als Katalysator werden dafür meist saure Ionentauscherharze verwendet.[8][3] Im Labormaßstab wird als Katalysator meist p-Toluolsulfonsäure verwendet.[9]
Nach dem Prinzip von Le Chatelier bewirkt eine Abtrennung des entstehenden Wassers bzw. das Abziehen des Esters eine Verlagerung des Gleichgewichts auf die Produktseite (siehe auch Massenwirkungsgesetz).
Eigenschaften
Essigsäure-n-butylester ist eine farblose Flüssigkeit mit fruchtartigem Geruch. Die Schmelztemperatur beträgt −76 °C. Der Siedepunkt unter Normaldruck liegt bei 126 °C.[10] Mit Wasser bildet die Verbindung ein azeotrop siedendes Gemisch. Bei Normaldruck und mit einem Wassergehalt von 26,7 Ma% liegt der azeotrope Siedepunkt bei 90,2 °C.[10]
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,26803, B = 1440,231 und C = −61,362 im Temperaturbereich von 332,9 bis 399,2 K.[11]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−609,6 kJ·mol−1[12]
−566,0 kJ·mol−1[12]als Flüssigkeit
als GasVerbrennungsenthalpie ΔcH0liquid −3467,0 kJ·mol−1[12] Wärmekapazität cp 225,11 J·mol−1·K−1 (25 °C)[13] als Flüssigkeit Kritische Temperatur Tc 575,4 K[14] Kritischer Druck pc 30,9 bar[14] Verdampfungsenthalpie ΔVH0 43,89 kJ·mol−1[15] beim Normaldrucksiedepunkt
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 64,07 kJ/mol, β = 0,306 und Tc = 579 K im Temperaturbereich zwischen 298 K und 358 K beschreiben.[15]
Sicherheitstechnische Kenngrößen
n-Butylacetat bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 27 °C. Der Explosionsbereich liegt zwischen 1,2 Vol.‑% (58 g/m3) als untere Explosionsgrenze (UEG) und ca. 8,5 Vol.‑% als obere Explosionsgrenze (OEG).[16] Der untere Explosionspunkt liegt bei 19,5 °C.[2][17] Der maximale Explosionsdruck beträgt 8,6 bar.[16] Die Grenzspaltweite wurde mit 1,02 mm bestimmt.[16] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[16] Die Zündtemperatur beträgt 390 °C.[16] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Essigsäure-n-butylester ist ein weitverbreitetes Lacklösungsmittel. So findet sich unter anderem dieses als Substitut für das verbotene Dichlormethan in Abbeizern. Ferner wird es auch im chemischen Labor als Lösungsmittel eingesetzt.
Außerdem benutzt man es im histologischen Analyseverfahren, wo es als „Intermedium“ Verwendung findet. Ein Intermedium wird vor dem Einbetten von histologischen Organen ins Paraffin dazwischengeschaltet, da sich Paraffin nicht mit Alkohol mischen kann (in Alkohol wurde das Organ vorher eingelegt). Das Intermedium sollte nebenbei letzte Wasserreste aus dem Organ entziehen, da es sonst beim Schneiden des Präparates störend wirken könnte. Es würde leichter reißen.
Aufgrund seiner starken Lösungskraft findet Essigsäure-n-butylester auch als Bestandteil von Nagellackentfernern und Verdünnern Verwendung. Essigsäure-n-butylester kommt unter anderem auch in Apfelsaft vor und wird dort als eine der Referenzsubstanzen für den Aromaindex Apfel verwendet.
Einzelnachweise
- ↑ Eintrag zu BUTYL ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- ↑ a b c d e f g h i j k l m Eintrag zu CAS-Nr. 123-86-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Februar 2017. (JavaScript erforderlich)
- ↑ a b Eintrag zu Butylacetate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. November 2018.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-76.
- ↑ Eintrag zu N-butyl acetate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 123-86-4 bzw. Essigsäure-n-butylester), abgerufen am 2. November 2015.
- ↑ Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- ↑ Zuber Laurent, Bailer Oliver, Sander Stefan, Meierhofer Heinz: Verfahren zur Herstellung von Carbonsäureester mittels einer Reaktivdestillation. In: Europäisches Patentamt. Sulzer Chemtech AG, 26. August 2009, abgerufen am 26. November 2018.
- ↑ Klaus Schwetlick u. a.: Organikum. 24. Auflage. Wiley-VCH, Weinheim 2015, ISBN 978-3-527-33968-6.
- ↑ a b H. Cheung, R. S. Tanke, G. P. Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a01_045.
- ↑ V. Kliment, V. Fried, J. Pick: Gleichgewicht Flussigkeit-Dampf. XXXIII. Systeme Butylacetat-Phenol und Wasser-Phenol. In: Collect Czech Chem Commun. 29, 1964, S. 2008–2015, doi:10.1135/cccc19642008.
- ↑ a b c M. Șchiopu, O. Bot, V. Onu: Studiul termodinamic și cinetic al sistemului acetat de n-butil-apa. Nota I. In: Bul. Inst. Politehnic Iași. 7, 1961, S. 115–118.
- ↑ E. Jimenez, L. Romani, Paz Andrade, M.I., Roux-Desgranges, G., J.-P. E. Grolier: Molar excess heat capacities and volumes for mixtures of alkanoates with cyclohexane at 25°C. In: J. Solution Chem. 15, 1986, S. 879–890.
- ↑ a b S. K. Quadri, A. P. Kudchadker: Measurement of the critical temperatures and critical pressures of some thermally stable or mildly unstable esters, ketones, and ethers. In: J. Chem. Thermodyn. 23, 1991, S. 129–134, doi:10.1016/S0021-9614(05)80288-5.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ a b c d e E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ E. Brandes, M. Mitu, D. Pawel: The lower explosion point — A good measure for explosion prevention: Experiment and calculation for pure compounds and some mixtures. In: J. Loss Prev. Proc. Ind. 20, 2007, S. 536–540, doi:10.1016/j.jlp.2007.04.028.