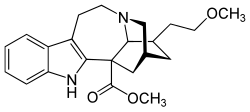
18-Methoxycoronaridin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 18-Methoxycoronaridin | ||||||||||||
| Andere Namen |
(−)-18-Methoxycoronaridin | ||||||||||||
| Summenformel | C22H28N2O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 368,47 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
18-Methoxycoronaridin (18-MC) ist eine halbsynthetische Substanz, die sich ableitet vom Alkaloid Coronaridin. Coronaridin ist strukturverwandt mit Ibogain, beides sind Indolalkaloide aus der Pflanzenfamilie der Apocynaceae.
Allgemeines
Nachdem 1962 Howard Lotsof die Entdeckung machte, dass Ibogain Entzugssymptome bei Opiat-Abhängigkeit zu lindern vermochte und darüber hinaus zur Verringerung des Suchtgefühls (Substanzverlangen) führte – also zu einem gewissen Abstinenzphänomen –, gelang es in den 1990er Jahren, diese zunächst anekdotischen Befunde wissenschaftlich zu untermauern. Da allerdings Ibogain Nebenwirkungen in bestimmten Personengruppen mit Vorerkrankungen hat, die einer eventuellen Zulassung als Medikament entgegenstehen, entwickelten Stanley Glick und Martin Kuehne Mitte der 1990er Jahre verschiedene Derivate, so auch das 18-MC, im Bemühen, Ibogain in seinem pharmakologischen Profil zu optimieren und darauf aufbauend, genauere Erkenntnisse zu gewinnen über Wirkzusammenhänge des Suchtgeschehens. Später wurden weitere Analoga synthetisiert und untersucht, darunter das 18-Methylaminocoronaridin (18-MAC).
Pharmakologie
18-MC wirkt ähnlich wie Ibogain, es hat allerdings weniger Nebenwirkungen. Es lindert im Tierversuch sowohl die Suchtstärke (Substanzverlangen) als auch Entzugserscheinungen bei Opiatabhängigkeit. Die suchtlindernden Eigenschaften von 18-MC oder Ibogain wurden interessanterweise auch nachgewiesen bei einer ganzen Reihe von weiteren stoffgebundenen Abhängigkeiten, z. B. bezüglich Nicotin, Alkohol, Amphetamin und Kokain.
18-MC und 18-MAC (18-Methylaminocoronaridin) sind nicht-kompetitive Antagonisten an einem speziellen Nicotin-Rezeptor, vom Subtyp α3β4, wobei 18-MAC die höhere Potenz besitzt.[2] Diese Blockade korreliert gut mit der beobachteten Anti-Substanzverlangens-Wirkung.[3] Selektive α3β4-Blocker mit hoher Potenz sind bis dato allerdings noch unbekannt. Im Gegensatz zu Ibogain haben diese Coronaridine keine Affinität am NMDA-Rezeptor und sind auch sonst im Bindungsprofil deutlich selektiver.[2][4]
18-MC verringert im Tierversuch die Selbstverabreichung von Morphin und Methamphetamin. 18-MAC ist dabei, verglichen mit 18-MC, in der Morphin-Reihe doppelt so effektiv, beim Methamphetamin jedoch weniger. Gegenüber Nicht-Suchtstoffen verhalten sich – anders als Ibogain – die Coronaridine neutral.[2]
Eine Affinitätschromatografie-Methode, um Substanzen effektiv auf ihre Affinität zur entsprechenden α3β4-Andockstelle zu prüfen (Screening), entwickelten Irving Wainer et al.[5] Eine milde bis moderate Affinität scheinen etliche ZNS-aktive Substanzen zu besitzen, unter ihnen Clozapin, SSRI-Antidepressiva, Methadon, Dextromethorphan, Laudanosin und Mecamylamin (ein ehemaliges Blutdruck-Medikament).[6]
Siehe auch
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c CJ. Pace et al.: Novel iboga alkaloid congeners block nicotinic receptors and reduce drug self-administration. In: Eur J Pharmacol., 2004, 492(2–3), S. 159–67, PMID 15178360.
- ↑ V. Panchal et al.: Attenuation of morphine withdrawal signs by intracerebral administration of 18-methoxycoronaridine. In: Eur J Pharmacol., 2005, 525(1–3), S. 98–104, PMID 16289028.
- ↑ SD. Glick et al.: (±)-18-Methoxycoronaridine: A Novel Iboga Alkaloid Congener Having Potential Anti-Addictive Efficacy. In: CNS Drug Reviews, 1999,5(1), S. 27–42; doi:10.1111/j.1527-3458.1999.tb00084.x.
- ↑ R. Moaddel, K. Jozwiak, R. Yamaguchi, C. Cobello, K. Whittington, T. K. Sarkar, S. Basak, I. W. Wainer: On-line screening of conformationally constrained nicotines and anabasines for agonist activity at the alpha3beta4- and alpha4beta2-nicotinic acetylcholine receptors using immobilized receptor-based liquid chromatographic stationary phases. In: Journal of Chromatography B. Band 813, Nummer 1–2, Dezember 2004, S. 235–240, doi:10.1016/j.jchromb.2004.09.042, PMID 15556538.
- ↑ K. Jozwiak et al.: Interaction of noncompetitive inhibitors with an immobilized α3β4 nicotinic acetylcholine receptor investigated by affinity chromatography, quantitative-structure activity relationship analysis, and molecular docking. In: J Med Chem., 2004, 47(16), S. 4008–4021, PMID 15267239.