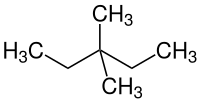
3,3-Dimethylpentan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 3,3-Dimethylpentan | ||||||||||||
| Summenformel | C7H16 | ||||||||||||
| Kurzbeschreibung |
leichtentzündbare farblose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 100,21 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
0,69 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
86 °C[1] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (5,9 mg·l−1 bei 25 °C[1]) | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
3,3-Dimethylpentan ist eine chemische Verbindung aus der Gruppe der aliphatischen gesättigten Kohlenwasserstoffe. Es ist eines der neun Konstitutionsisomere des Heptans.
Gewinnung und Darstellung
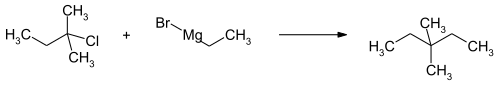
3,3-Dimethylpentan kann durch die Isomerisierung von n-Heptan erhalten werden, wo die Verbindung aus dem resultierenden Isomerengemisch abgetrennt werden muss.[3][4][5] Eine Laborsynthese erfolgt über die Umsetzung der Grignardverbindung aus Ethylbromid mit Amylchlorid mit 2-Chlor-2-methylbutan.[6]
Eigenschaften
Physikalische Eigenschaften
3,3-Dimethylpentan ist ein leichtentzündliche und farblose Flüssigkeit.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,95568, B = 1230,986 und C = −47,568 im Temperaturbereich von 287 bis 360 K.[7] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 47,53 kJ/mol, β = 0,2661 und Tc = 536,3 K im Temperaturbereich zwischen 298 K und 359 K beschreiben.[8] In fester Phase existieren zwei polymorphe Kristallformen, die unterschiedliche Schmelzpunkte zeigen. Beide Formen stehen enantiotrop zueinander. Die Umwandlungstemperatur zwischen beiden Formen liegt bei −140,45 °C.[2]
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Eigenschaft | Typ | Wert [Einheit] |
|---|---|---|
| Standardbildungsenthalpie | ΔfH0gas ΔfH0liquid |
−201,5 kJ·mol−1[9] −234,6 kJ·mol−1[9] |
| Verbrennungsenthalpie | ΔcH0liquid | −4806,70 kJ·mol−1[9] |
| Wärmekapazität | cp | 214,8 J·mol−1·K−1 (25 °C)[2] als Flüssigkeit |
| Schmelzenthalpie | ΔfH0 | 6,8463 kJ·mol−1[2] Polymorph I 7,6425 kJ·mol−1[2] Polymorph II |
| Schmelzentropie | ΔfS0 | 49,34 kJ·mol−1[2] Polymorph I 55,30 kJ·mol−1[2] Polymorph II |
| Umwandlungsenthalpie | ΔtH0 | 0,7937 kJ·mol−1[2] Polymorph II zu Polymorph I |
| Umwandlungsentropie | ΔtS0 | 5,98 kJ·mol−1[2] Polymorph II zu Polymorph I |
| Verdampfungsenthalpie | ΔVH0 | 29,62 kJ·mol−1[8] beim Normaldrucksiedepunkt 33,15 kJ·mol−1[8] bei 25 °C |
| Kritische Temperatur | TC | 263,25 °C[10] |
| Kritischer Druck | PC | 29,5 bar[10] |
| Kritisches Volumen | VC | 0,414 l·mol−1[10] |
| Kritische Dichte | ρC | 2,42 mol·l−1[10] |
Sicherheitstechnische Kenngrößen
3,3-Dimethylpentan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von −15 °C.[1] Der Explosionsbereich liegt zwischen 0,9 Vol.‑% (40 g/m3) als untere Explosionsgrenze (UEG) und 6,9 Vol.‑% (285 g/m3) als obere Explosionsgrenze (OEG).[11] Die Zündtemperatur beträgt 320 °C.[11] Der Stoff fällt somit in die Temperaturklasse T2.
Historisches
1866 und 1867 berichteten Charles Friedel und Albert Ladenburg über eine Synthese des 3,3-Dimethylpentans, von ihnen „Carbdimethyldiäthyl“ genannt, ausgehend vom 2,2-Dichlorpropan.[12]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu 3,3-Dimethylpentan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ a b c d e f g h i j Finke, H.L.; Messerly, J.F.; Douslin, D.R.: Low-temperature thermal quantities for five alkyl-substituted pentanes in J. Chem. Thermodynam. 8 (1976) 965–983, doi:10.1016/0021-9614(76)90113-0.
- ↑ Houzvicka, J.; Blom, N.J.: Patent US2004/59174 A1, 2004.
- ↑ Gillespie, R.D.: Patent US2004/249231 A1, 2004.
- ↑ Herbst, K.; Stern, P.; Blom, N.J.; Starch-Hytoft, G.; Knudsen, K.G.: Patent US2007/123745 A1, 2007.
- ↑ Marker, R.E.; Oakwood, T.S.: Hexamethylethane and Tetraalkylmethanes in J. Am. Chem. Soc. 60 (1938) 2598, doi:10.1021/ja01278a011.
- ↑ Forziati, A.F.; Norris, W.R.; Rossini, F.D.: Vapor Pressures and Boiling Points of Sixty API-NBS Hydrocarbons in J. Res. Natl. Bur. Stand. (U.S.) 43 (1949) 555–563, doi:10.6028/jres.043.050.
- ↑ a b c Majer, V.; Svoboda, V.: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- ↑ a b c Prosen, E.J.; Rossini, F.D.: Heats of combustion and formation of the paraffin hydrocarbons at 25° C in J. Res. Natl.Bur. Stand. 1945, 263–267.
- ↑ a b c d Daubert, T. E.: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes in J. Chem. Eng. Data 41 (1996) 365–372, doi:10.1021/je9501548.
- ↑ a b E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Charles Friedel, Albert Ladenburg: Ueber die Synthese eines Kohlenwasserstoffs und dessen Constitution. In: Friedrich Wöhler, Justus Liebig, Hermann Kopp (Hrsg.): Justus Liebigs Annalen der Chemie. Band 142, Nr. 3. C. F. Winter'sche Verlagshandlung / Wiley-VCH, Leipzig und Heidelberg 1867, S. 310–322, doi:10.1002/jlac.18671420310 (online bei der Bayerischen Staatsbibliothek BSB/Münchener Digitalisierungszentrum MDZ).